[Bài 10 Hóa 11 Photpho] và giải bài 1,2,3 trang 49; bài 4,5 trang 50 SGK Hóa lớp 11: Photpho – Chương 2
A. Lý thuyết về photpho
1. Trong bảng tuần hoàn photpho ở ô thứ 15, nhóm VA, chu kì 3.
Cấu hình electron lớp ngoài cùng: 3s23p3.
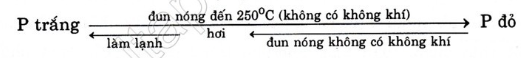
2. Photpho tạo thành hai dạng thù hình quan trọng: photpho trắng và photpho đỏ.
Photpho trắng: Chất rắn màu trắng hoặc hơi vàng, rất độc, không tan trong nước và dễ tan trong dung môi hữu cơ.
Photpho đỏ: Chất rắn có màu đỏ, không độc, không tan trong các dung môi thông thường.
P đỏ (rắn) → t0 cao P đỏ (hơi) → P trắng.
Hai dạng này khác nhau về tính chất vật lí do chúng khác nhau về cấu trúc tinh thể và khả năng liên kết. Trong hai dạng thù hình photpho trắng hoạt động hơn photpho đỏ.
3. Phân tử photpho chỉ có liên kết đơn nên photpho hoạt động hơn nitơ ở điều kiện thường. Photpho vừa có tính oxi hóa (tác dụng với một số kim loại K, Na, Ca,…) vừa có tính khử (khử O2, Cl2, một số hợp chất).
4. Trong tự nhiên photpho nằm ở dạng muối của axit photphoric. Hai khoáng vật chính của photpho là aptit 3Ca3(PO4)2 . CaF2 và photphorit Ca3(PO4)2.
5. Trong công nghiệp, photpho được sản xuất bằng cách nung hỗn hợp quặng photphorit, cát và than cốc ở 12000C trong lò điện:
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO
Phần lớn photpho sản xuất ra được dùng để sản xuất axit photphoric, phần còn lại chủ yếu dùng trong sản xuất diêm. Ngoài ra, photpho còn được dùng vào mục đích quân sự: sản xuất bom, đạn cháy, đạn khói,…
6. Viết các phương trình hóa học minh họa cho tính chất hóa học của photpho. Giải được các bài tập: Tính khối lượng sản phẩm tạo thành qua nhiều phản ứng hóa học, các bài toán về các phản ứng thể hiện tính oxi hóa – khử của photpho và một số bài tập tổng hợp có nội dung liên quan.
B. Gợi ý trả lời các câu hỏi và bài tập Hóa lớp 11 bài 10 trang 49, 50
Bài 1. Nêu những điểm khác nhau về tính chất vật lí giữa P trắng và P đỏ. Trong điều kiện nào P trắng chuyển thành P đỏ và ngược lại ?
p trắng:
Chất rắn màu trắng hoặc hơi vàng
Dễ nóng chảy, rất độc
Tan trong một số dung môi hữu cơ
Advertisements (Quảng cáo)
Phát quang trong bóng tối
Bốc cháy trong không khí ở t° > 40°c
P đỏ:
Chất bột màu đỏ
Khó nóng chảy, không độc Không tan trong các dung môi thông thường
Không phát quang trong bóng tối
Bốc cháy trong không khí ở t° > 250°c
Bài 2. (trang 49 Hóa lớp 11) Lập phương trình hóa học của các phản ứng sau đây và cho biết trong các phản ứng này, P có tính khử hay tính oxi hóa:
P + O2 → P2O5
P + Cl2 → PCl3
P + S → P2S3
Advertisements (Quảng cáo)
P + S → P2S5
P + Mg → Mg3P2
P + KClO3 → P2O5 + KCl
Hướng dẫn giải bài 2:
(5): p thể hiện tính oxi hóa
(1) (2) (3) (4) (6): p thể hiện tính khử 3
Bài 3. Thí nghiệm ở hình 2.13 chứng minh khả năng bốc cháy khác nhau của P trắng và P đỏ. Hãy quan sát, mô tả và giải thích hiện tượng xảy ra trong thí nghiệm. Viết phương trình hóa học của phản ứng xảy ra.
Lời giải bài 3: Khi đun nóng khay sắt chứa p đỏ và p trắng (lưu ý rằng p trắng để xa nguổn nhiệt hơn) thì miếng p trắng cháy sáng, còn miếng p đỏ tuy gần nguồn nhiệt nhưtìg vẫn chưa bốc cháy, chứng tỏ p trắng hoạt động hóa học mạnh hơn p đỏ.
4P + 502 -> 2P2O5
Bài 4. Nêu những ứng dụng của photpho. Những ứng dụng đó xuất phát từ tính chất gì của photpho ?
Trả lời: Những ứng dụng của photpho như SGK. Mỗi ứng dụng đó xuất phát từ tính khử hoặc tính oxi hóa của photpho.
Bài 5. (trang 50 Hóa 11): Đốt cháy hoàn toàn 6,2 g photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính khối lượng dung dịch NaOH đã dùng.
c) Tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng.
Hướng dẫn giải bài 5:
a) 4P + 5O2 → t0 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)
b) Số mol P tham gia phản ứng:
6,20/31 = 0,200 (mol)
Từ (1) và (2) có sơ đồ hợp thức:
2P → P2O5 → 4NaOH → 2Na2HPO4 (3)
2 mol 1 mol 4 mol 2 mol
0,200 mol 0,100 mol 0,400 mol 0,200 mol
Từ đó tính được số gam dung dịch NaOH 32,0 % đã dùng là 50,0 gam.
c) Dựa vào (3) tính được 0,200 mol Na2HPO4.
MddNa2HPO4 = 14,2 gam + 50,0 gam = 64,2 (g)
C% dd Na2HPO4 = … x 100% = 44,2 %