Bài 2.9: Để phân biệt dung dịch glucozơ và dung dịch fructozơ người ta không thể dùng phản ứng tráng bạc mà dùng nước brom. Hãy giải thích vì sao và viết phương trình hoá học của các phản ứng xảy ra.
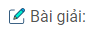
Glucozơ có chức anđehit nên có phản ứng tráng bạc :
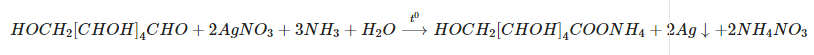
Fructozơ không có chức anđehit nhưng trong môi trường bazơ, fructozơ chuyển thành glucozơ nên cũng cho phản ứng tráng bạc.
Dung dịch glucozơ làm mất màu nước brom :
C5H11O5CHO + Br2 + H2O → C5H11O5COOH + 2HBr
Fructozơ không làm mất màu nước brom.
Bài 2.10: Nêu những phản ứng hoá học chứng minh các đặc điểm sau đây của fructozơ :
a) Có nhiều nhóm OH ở những nguyên tử cacbon kề nhau.
b) Tổng số nhóm OH trong phân tử là 5.
c) Có nhóm chức xeton.
d) Có mạch cacbon không phân nhánh.
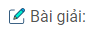
a) fructozơ tác dụng với Cu(OH)2 cho dung dịch xanh lam chứng tỏ phân tử fructozơ có nhiều nhóm OH ở vị trí kề nhau
b) fructozơ tạo este chứa 5 gốc axit CH3COO chứng tỏ phân tử có 5 nhóm OH
c) fructozơ cộng Hidro cho poliancol C6H14O6 chứng tỏ phân tử có nhóm chức xeton
Advertisements (Quảng cáo)
d) khử hoàn toàn fructozơ thu được hexan chứng tỏ có 6 nguyên tử C trong phân tử fructozơ tạo thành một mạch không phân nhánh.
Bài 2.11: Trình bày phương pháp hoá học để nhận biết bốn dung dịch : glixerol, anđehit axetic, axit axetic, glucozơ.
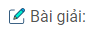
Dùng giấy quỳ tím nhận biết được dung dịch axit axetic. Trong ba dung dịch còn lại, dung dịch nào không tham gia phản ứng tráng bạc là glixerol. Để phân biệt dung dịch glucozơ và dung dịch anđehit axetic có thể dùng phản ứng với Cu(OH)2 ở nhiệt độ thường, glucozơ tạo ra dung dịch xanh lam.
![]()
Bài 2.12: Xuất phát từ glucozơ và các chất vô cơ, viết các phương trình hoá học để điều chế ra bốn muối khác nhau của kali, biết trong thành phần các muối đó đều có cacbon.
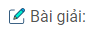
\(\eqalign{
& {C_5}{H_{11}}{O_5}CHO + 2Cu{\left( {OH} \right)_2} + KOH\buildrel {{t^0}} \over
\longrightarrow {C_5}{H_{11}}{O_5}COOK + C{u_2}O + 3{H_2}O \cr
& glucozo\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,kali\,gluconat \cr
& {C_6}{H_{12}}{O_6}\mathrel{\mathop{\kern0pt\longrightarrow}
\limits_{30 – {{35}^0}C}^{enzim}} 2{C_2}{H_5}OH + 2C{O_2} \cr
& C{O_2} + KOH \to KHC{O_3} \cr
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,kali\,hidrocacbonat \cr
& C{O_2} + 2KOH \to {K_2}C{O_3} + {H_2}O \cr
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,kali\,cacbonat \cr
& {C_2}{H_5}OH + {O_2}\mathrel{\mathop{\kern0pt\longrightarrow}
\limits_{25 – {{30}^0}C}^{men\,giấm}} C{H_3}COOK + {H_2}O \cr
& C{H_3}COOH + KOH \to C{H_3}COOK + {H_2}O \cr
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,kali\,axetat \cr} \)
Bài 2.13: Từ nguyên liệu là glucozơ và các chất vô cơ, người ta có thể điều chế một ete và một este đều có 4 nguyên tử cacbon. Hãy viết các phương trình hoá học. Ghi tên ete và este thu được.
Advertisements (Quảng cáo)
– Điều chế đietyl ete
\(\eqalign{
& {C_6}{H_{12}}{O_6}\buildrel {enzim,{\rm{ }}30 – {{35}^0}C} \over
\longrightarrow 2{C_2}{H_5}OH + 2C{O_2} \uparrow \cr
& 2{C_2}{H_5}OH\buildrel {{H_2}S{O_4},{{140}^0}C} \over
\longrightarrow {C_2}{H_5} – O – {C_2}{H_5} + {H_2}O \cr} \)
– Điều chế etyl axetat
\({C_2}{H_5}OH + {O_2}\buildrel {men{\rm\,{ }}giấm} \over
\longrightarrow C{H_3}COOH + {H_2}O\)
\(C{H_3}COOH + {C_2}{H_5}OH\buildrel {{t^0},{\rm{ }}{H_2}S{O_4}\left( \right)} \over
\longrightarrow C{H_3}COO{C_2}{H_5} + {\rm{ }}{H_2}O\)
Bài 2.14: Rượu 40° là dung dịch ancol etylic trong nước, trong đó ancol etylic chiếm 40% về thể tích. Người ta dùng một loại nguyên liệu chứa 50% glucozơ để lên men thành rượu với hiệu suất 80%. Để thu được 2,3 lít rượu 40° cần dùng bao nhiêu kilogam nguyên liệu nói trên ? Biết rằng khối lượng riêng của ancol etylic là 0,8 g/ml
Khối lựợng ancol etylic trong 2,3 lít (2300 ml) rượu 40° là: \(2300.{{40} \over {100}}.0,8 = 736g\)
PT:
\({C_6}{H_{12}}{O_6}\buildrel {enzim,{\rm{ }}30 – {{35}^0}C} \over
\longrightarrow 2{C_2}{H_5}OH + 2C{O_2} \uparrow \)
Khối lượng nguyên liệu: \({{180.736} \over {92}}.{{100} \over {80}}.{{100} \over {50}} = 3600g = 3,6kg\).
Bài 2.15: Hoà tan 2,68 g hỗn hợp axetanđehit và glucozơ vào nước. Cho dung dịch thu được vào 35,87 ml dung dịch 34% AgNO3 trong amoniac (khối lượng riêng 1,4 g/ml) và đun nóng nhẹ để phản ứng xảy ra hoàn toàn. Lọc bỏ kết tủa rồi trung hoà nước lọc bằng axit nitric, sau đó thêm vào nước lọc đó lượng vừa đủ dung dịch kali clorua, khi đó xuất hiện 5,74 g kết tủa. Tính phần trăm khối lượng từng chất trong hỗn hợp han đầu.
nAgNO3 =\(35,87.1.4.{{34} \over {100.170}} = 0,1mol\)
n AgCl= 0,04mol
Gọi số mol của axetandehit, glucozơ lần lượt là x, y
→ mhh= 44x + 180y= 2,68 (1)
Các phản ứng xảy ra:
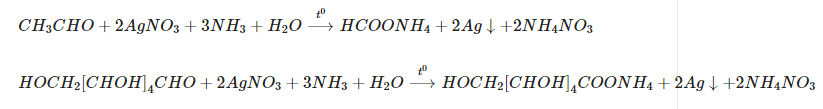
AgNO3 dư có phản ứng với KCl tạo kết tủa:
AgNO3 + KCl → AgCl + KNO3
→ n AgNO3 pư = 0,1-0,04= 0,06 mol
Từ pt → 2x + 2y = 0,06 (2)
Từ (1) và (2) suy ra x= 0,02 ; y=0,01
%m CH3CHO= \({{0,02.44} \over {2,68}}.100 = 32,84\% \)
% m C6H12O6= 100- 32,84= 67,16%

