Câu 4. Nêu những tính chất hoa học đặc trưng của nitơ và dẫn ra những phản ứng hóa học để minh họa ?
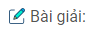
Tính chất hóa học của \({N_2}\) : \({N_2}\) thể hiện tính khử và tính oxi hóa.
– Nitơ thể hiện tính khử:
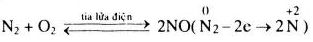
– Nitơ thể hiện tính oxi hóa:
Câu 5. Bằng thí nghiệm nào có thể biết được nitơ có lẫn một trong những tạp chất: clo, hiđro, clorua, hiđro sunfua ? Viết phương trình hóa học vủa các phản ứng xảy ra.
Giải
Advertisements (Quảng cáo)
– Dẫn hỗn hợp khí trên qua dung dịch (KI + hồ tinh bột) thấy có màu xanh xuất hiện có khí clo \(C{l_2} + 2KI \to 2KCl + {I_2}\).
– Dẫn qua dung dịch \(Cu{\left( {N{O_3}} \right)_2}\) có \( \downarrow \) đen là \({H_2}S\)
\({H_2}S + Cu{\left( {N{O_3}} \right)_2} \to CuS \downarrow đen + 2HN{O_3}\)
– Dẫn qua dung dịch \(AgN{O_3}\) \( \downarrow \) có trắng là HCl
Advertisements (Quảng cáo)
\(HCl + AgN{O_3} \to AgCl \downarrow trắng + HN{O_3}\)
Câu 6. Trộn 200,0ml dung dịch nitrit 3,0M với 200,0ml dung dịch amoni clorua 2,0M rồi đun nóng cho đến khi phản ứng thực hiện xong. Xác định thể tích của khí nitơ sinh ra (đo ở đktc) và nồng độ mol của các muối trong dung dịch sau phản ứng. Giả thiết thể tích của dung dịch biến đổi không đáng kể.
\({n_{N{H_4}Cl}} = 2.0,2 = 0,4mol\)
\({n_{NaN{O_2}}} = 0,2.3 = 0,6mol\)
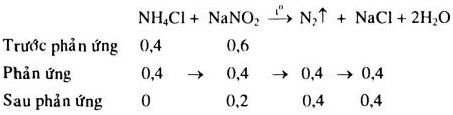
Thể tích \({N_2}\) sinh ra ở đktc: \({V_{{N_2}}} = 0,4.22,4 = 8,96\) (lít)
Dung dịch sau phản ứng có thể tích = 0,2 + 0,2 = 0,4 (lít)
Nồng độ mol/lít của các muối: \({CM_{{{NaCl}}}} = \frac{{0,4}}{{0,4}} = 1M;{CM_{{{NaN{O_2}}}}} = \frac{{0,2}}{{0,4}} = 0,5M.\)

