Bài 7.7: Các yếu tố như nhiệt độ, áp suất chất khí, chất xúc tác và diện tích bề mặt chất rắn có ảnh hưởng lớn đến tốc độ phản ứng hoá học. Tuỳ theo phản ứng hoá học cụ thể mà vận dụng một, một số hay tất cả các yếu tố trên để tăng hay giảm tốc độ phản ứng. Trong những trường hợp dưới đây, yếu tố nào trong số các yếu tố trên ảnh hưởng đến tốc độ phản ứng ?
a) Sự cháy diễn ra mạnh và nhanh hơn khi đưa lưu huỳnh đang cháy ngoài không khí vào lọ đựng khí oxi.
b) Khi cần ủ bếp than, người ta đậy nắp bếp lò làm cho phản ứng cháy của than chậm lại.
c) Phản ứng oxi hoá lưu huỳnh đioxit tạo thành lưu huỳnh trioxit diễn ra nhanh hơn khi có mặt vanađi oxit (\(V_2O_5\)).
d) Nhôm bột tác dụng với dung dịch axit clohiđric nhanh hơn so với nhôm dây.
Các yếu tố ảnh hưởng đến tốc độ phản ứng trong mỗi trường hợp đã cho là :
a) Tăng nồng độ chất tham gia phản ứng (khí oxi) làm tăng tốc độ phản ứng.
b) Giảm nồng độ chất tham gia phản ứng (khí oxi) làm giảm tốc độ phản ứng.
c) \(V_2O_5\) là chất xúc tác, làm tăng tốc độ phản ứng.
d) Giảm kích thước hạt để tăng tốc độ phản ứng.
Bài 7.8: Bảng số liệu sau đây cho biết thể tích khí hiđro thu được theo thời gian của phản ứng giữa kẽm (dư) với axit clohiđric.
|
Thời gian (giây) |
0 |
20 |
40 |
60 |
80 |
100 |
120 |
140 |
|
Thể tích H2 (ml) |
0 |
20 |
30 |
35 |
38 |
40 |
40 |
40 |
a) Hãy vẽ đồ thị biểu diễn sự phụ thuộc thể tích khí hiđro theo thời gian.
Từ đồ thị hãy cho biết khoảng thời gian nào phản ứng xảy ra nhanh nhất ?
Ở thời điểm phản ứng kết thúc, hình dạng đồ thị như thế nào ?
Advertisements (Quảng cáo)
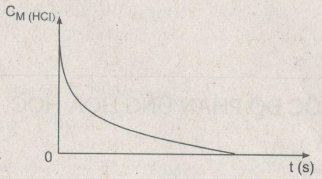
b) Nếu xác định được nồng độ của axit clohiđric theo thời gian phản ứng thì đồ thị biểu diễn sự phụ thuộc đó có dạng như thế nào ?
a)
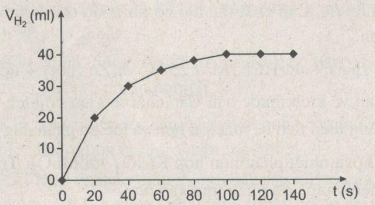
Từ 0 giây đến 20 giây là đoạn đồ thị dốc nhất, đó là khoảng thời gian phản ứng có tốc độ cao nhất.
Ở thời điểm phản ứng kết thúc, đồ thị nằm ngang, thể tích hiđro thu được là cực đại 40 ml. Tại thời điểm đó axit clohiđric đã phản ứng hết.
b) Dạng đồ thị biểu diễn sự phụ thuộc của nồng độ axit HCL theo thời gian
Advertisements (Quảng cáo)
Bài 7.9: Hãy cho biết người ta đã sử dụng biện pháp nào để tăng tốc độ phản ứng hoá học trong các trường hợp sau đây :
a) Rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn.. ) để ủ rượu.
b) Tạo thành những lỗ rỗng trong viên than tổ ong.
c) Nén hỗn hợp khí nitơ và hiđro ở áp suất cao để tổng hợp amoniac.
d) Nung hỗn hợp bột đá vôi, đất sét và thạch cao ở nhiệt độ cao để sản xuất clinke trong công nghiệp sản xuất’ xi măng.
e) Dùng phương pháp ngược dòng trong sản xuất axit sunfuric.
a) Men rượu là một loại xúc tác sinh học. Chất xúc tác đã được sử dụng để tăng tốc độ của phản ứng hoá học.
b) Những lỗ rỗng trong viên than tổ ong làm tăng diện tích tiếp xúc giữa than và oxi không khí, do đó làm tăng tốc độ của phản ứng hoá học.
c) Nén hỗn hợp khí nitơ và hiđro ở áp suất cao để tăng nồng độ của hai chất khí, làm tăng tốc độ của phản ứng hoá học.
d) Dùng biện pháp tăng nhiệt độ để tăng tốc độ của phản ứng hoá học.
e) Dùng phương pháp ngược dòng, anhiđrit sunfuric đi từ dưới lên, axit sunfuric 98% đi từ trên đỉnh tháp hấp thụ xuống để tăng diện tích tiếp xúc giữa các chất, do đó, làm tăng tốc độ của phản ứng hoá học.
Bài 7.10: Trong mỗi cặp phản ứng sau, phản ứng nào có tốc độ lớn hơn ?
a) Fe + dd HCL 0,1M và Fe + dd HCL 2M ở cùng một nhiệt độ.
b) Al + dd NaOH 2M ở 25°C và Al + dd NaOH 2M ở 50°C.
c) Zn (hạt) + dd HCL 1M ỏ 25°C và Zn (bột) + dd HCI 1M ở 25°C
d) Nhiệt phân riêng và nhiệt phân hỗn hợp \(KClO_3\) với \(MnO_2\).
a) ở cùng một nhiệt độ, cặp chất Fe + dd HCL 0,1M có tốc độ phản ứng xảy ra chậm hơn so với cặp chất Fe + dd HCL 2M, do nồng độ HCL nhỏ hơn.
b) Hai cặp chất AI + dd NaOH 2M ở 25 °C và Al + dd NaOH 2M ở 50 °C chỉ khác nhau về nhiệt độ. Cặp chất thứ hai có nhiệt độ cao hơn nên có tốc độ phản ứng cao hơn.
c) Hai cặp chất Zn (hạt) + dd HCl 1M ở 25 °C và Zn (bột) + dd HCL 1M ở 25°C chỉ khác nhau về kích thước hạt. Cặp chất thứ hai có kích thước hạt nhỏ hơn, do đó có tổng diện tích bề mặt lớn hơn và tốc độ phản ứng cao hơn.
d) Nhiệt phân \(KClO_3\) và nhiệt phân hỗn hợp \(KClO_3\) với \(MnO_2\). Trường hợp thứ hai có xúc tác nên có tốc độ phản ứng cao hơn.

