Bài 6: Hãy nêu thí dụ về phản ứng tạo ra muối:
a) Từ hai đơn chất;
b) Từ hai hợp chất;
c) Từ một đơn chất và một hợp chất.
Hãy cho biết các phản ứng đó có phải là phản ứng oxi hóa – khử hay không? Giải thích.
Phản ứng tạo muối:
a) Từ hai đơn chất: \(Fe + S\,\, \to \,\,FeS;\)
\(2Na + C{l_2}\,\, \to \,\,2NaCl\)
b) Từ hai hợp chất:
\(HCl + KOH\,\, \to \,\,KCl + {H_2}O;\)
\({K_2}O + C{O_2}\,\, \to \,\,{K_2}C{O_3}\)
c) Từ một đơn chất và một hợp chất:
\(\eqalign{ & Al + 6HN{O_3}\,\, \to \,\,Al{\left( {N{O_3}} \right)_3} + 3N{O_2} \uparrow + 3{H_2}O \cr & C{l_2} + 2KOH\,\, \to \,\,KCl + KClO + {H_2}O \cr} \)
Ở phản ứng a) và c) có sự thay đổi số oxi hóa của các nguyên tố, ở phản ứng b) số oxi hóa không có sự thay đổi số oxi hóa.
Bài 7: NaOH có thể được điều chế bằng:
a) Một phản ứng hóa hợp;
Advertisements (Quảng cáo)
b) Một phản ứng thế;
c) Một phản ứng trao đổi.
– Hãy dẫn ra phản ứng hóa học của mỗi trường hợp trên.
– Hãy cho biết các phản ứng đó có phải là phản ứng oxi hóa – khử hay không? Giải thích.
Phản ứng điều chế NaOH
a) Một phản ứng hóa hợp: \(N{a_2}O + {H_2}O\,\, \to \,\,2NaOH.\)
b) Một phản ứng thế: \(2Na + 2{H_2}O\,\, \to \,\,2NaOH + {H_2} \uparrow \)
c) Một phản ứng trao đổi: \(N{a_2}C{O_3} + Ba{\left( {OH} \right)_2}\,\, \to \,\,2NaOH + BaC{O_3}\)
Ở phản ứng b) là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng; phản ứng a) và c) không là phản ứng oxi hóa – khử vì không có sự thay đổi số oxi hóa.
Advertisements (Quảng cáo)
Bài 8: Hãy cho biết số oxi hóa của nitơ trong các phân tử và ion dưới đây:
|
Đinitơ oxit \({N_2}O,\) Hiđrazin \({N_2}{H_4}\); Nitơ đioxit \(N{O_2}\); Axit nitrơ \(HN{O_2}\); Khí nitơ \({N_2}.\) |
Axit nitric \(HN{O_3}\); Hiđroxylamin \(N{H_2}OH\); Ion nitrat \(NO_3^ – \); Đinitơ pentaoxit \({N_2}{O_5}\); Nitơ monooxit NO. |
Ion nitrit \(NO_2^ – \); Amoniac \(N{H_3}\); Ion hiđrazini \({N_2}H_5^ + \) Ion amoni \(NH_4^ + \) Đinitơ tetraoxit \({N_2}{O_4}.\) |
Số oxi hóa của nitơ trong các phân tử và ion là:
\(\eqalign{ & \mathop {{N_2}}\limits^{ + 1} O;\,\,\mathop {{N_2}}\limits^{ – 2} {H_4};\,\,\mathop N\limits^{ + 4} {O_2};\,\,H\mathop N\limits^{ + 3} {O_2};\,\,\mathop {{N_2}}\limits^0 ;\,\,H\mathop N\limits^{ + 5} {O_3}; \cr & \,\,\mathop N\limits^{ – 1} {H_2}OH; \;\mathop N\limits^{ + 5} O_3^ – ;\,\,\mathop {{N_2}}\limits^{ + 5} {O_5};\,\,\mathop N\limits^{ + 2} O;\,\,\mathop N\limits^{ + 3} O_2^ – ;\,\,\mathop N\limits^{ – 3} {H_3};\cr&\,\,\mathop {{N_2}}\limits^{ – 2} H_5^ + ;\,\,\mathop {{N_2}}\limits^{ + 4} {O_4};\,\,\mathop N\limits^{ – 3} H_4^ + \cr} \)
Bài 9: Lập phương trình hóa học của các phản ứng oxi hóa – khử dưới đây:
\(\eqalign{ & a)\,\,NaClO + KI + {H_2}S{O_4} \to {I_2} + NaCl + {K_2}S{O_4} \cr&\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;+ {H_2}O \cr & b)\,\,C{r_2}{O_3} + KN{O_3} + KOH \to {K_2}Cr{O_4} + KN{O_2} \cr&\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;+ {H_2}O \cr & c)\,\,Al + F{e_3}{O_4} \to A{l_2}{O_3} + Fe \cr & d)\,\,Fe{S_2} + {O_2} \to F{e_2}{O_3} + S{O_2} \cr & e)\,\,Mg + HN{O_3} \to Mg{\left( {N{O_3}} \right)_2} + N{H_4}N{O_3}\cr&\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; + {H_2}O. \cr} \)
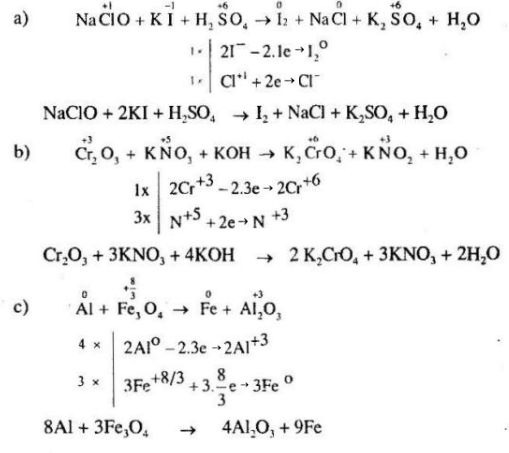
Bài 10: Hoàn thành các phương trình hóa học dưới đây:
\(\eqalign{ & a)\,\,KMn{O_4} + HCl \to C{l_2} + MnC{l_2} + … \cr & b)\,\,S{O_2} + HN{O_3} + {H_2}O \to NO + … \cr & c)\,\,A{s_2}{S_3} + HN{O_3} + {H_2}O \to {H_3}As{O_4} + NO \cr&\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;+ {H_2}S{O_4}. \cr} \)
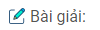
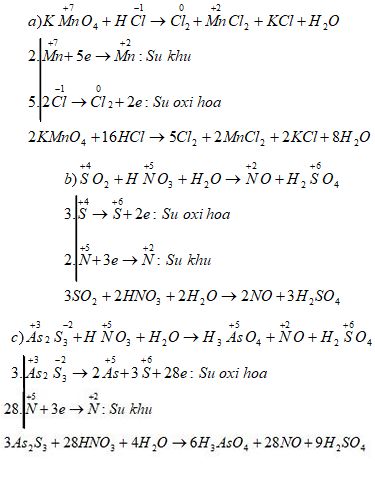
Bài 11: Cho kali iotua tác dụng với kali pemanganat trong dung dịch axit sunfuric, người ta thu được 1,2 g mangan (II) sunfat.
a) Tính số gam iot tạo thành.
b) Tính khối lượng kali iotua tham gia phản ứng.
a) Tính số gam iot tạo thành.
Phản ứng xảy ra:
\(10KI + 2KMn{O_4} + 8{H_2}S{O_4}\,\, \to \,\,6{K_2}S{O_4} \)
\(+ 2MnS{O_4} + 5{I_2} + 8{H_2}O\,\,\,\,\,\left( 1 \right)\)
Ta có: \({n_{MnS{O_4}}} = {{1,2} \over {151}}\,\,mol\)
Theo (1): \({n_{{I_2}}} = {5 \over 2}{n_{MnS{O_4}}} = {5 \over 2}.{{1,2} \over {151}} \approx 0,0,2\,\,mol\)
\( \Rightarrow \) Khối lượng iot tạo thành là: \(0,02.254 = 5,08\,\,gam.\)
b) Tính khối lượng kali iotua tham gia phản ứng:
Từ (1)\( \Rightarrow {n_{KI}} = 5{n_{MnS{O_4}}} = 5.{{1,2} \over {151}} \approx 0,04\,\,mol\)
Khối lượng kali iotua tham gia phản ứng là: \({m_{KI}} = 0,04.166 = 6,64\,\,\left( {gam} \right).\)

