Bài 1: Trong các phản ứng hóa hợp dưới đây, phản ứng nào là phản ứng oxi hóa – khử?
\(\eqalign{ & A.\,\,CaC{O_3} + {H_2}O + C{O_2} \to Ca{\left( {HC{O_3}} \right)_2} \cr & B.\,\,{P_2}{O_5} + 3{H_2}O \to 2{H_3}P{O_4} \cr & C.\,\,2S{O_2} + {O_2} \to 2S{O_3} \cr & D.\,\,BaO + {H_2}O \to Ba{\left( {OH} \right)_2} \cr} \)
Phản ứng \(2\mathop S\limits^{ + 4} {O_2} + \mathop {{O_2}}\limits^0 \,\, \to \,\,2\mathop S\limits^{ + 6} \mathop {{O_3}}\limits^{ – 2} :\) Là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của các nguyên tố.
Chọn C.
loigiaihay.com
Bài 2: rong các phản ứng phân hủy dưới , đâyphản ứng nào không phải là phản ứng oxi hóa – khử?
\(\eqalign{ & A.\,\,2KMn{O_4} \to {K_2}Mn{O_4} + Mn{O_2} + {O_2} \cr & B.\,\,2Fe{\left( {OH} \right)_3} \to F{e_2}{O_3} + 3{H_2}O \cr & C.\,\,4KCl{O_3} \to 3KCl{O_4} + KCl \cr & D.\,\,2KCl{O_3} \to 2KCl + 3{O_2} \cr} \)
Chọn B.
loigiaihay.com
Bài 3: Cho bảng tóm tắt dưới đây:
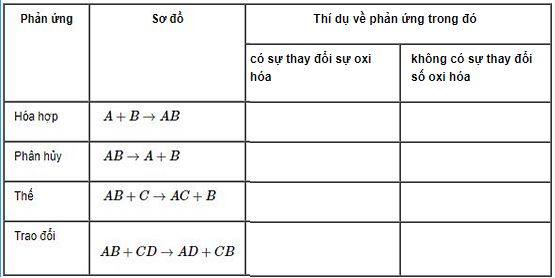
Hãy điền các thí dụ vào ô trống, mỗi ô ghi hai phương trình hóa học (nếu có) không trùng với các phản ứng trong bài, có ghi rõ số oxi hóa của các nguyên tố. Để trống các ô không có phản ứng thích hợp
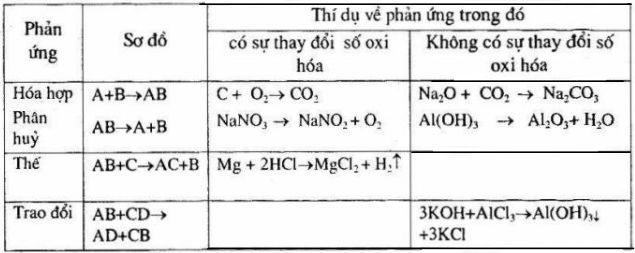
loigiaihay.com
Bài 4: Người ta có thể tổng hợp amoniac \(\left( {N{H_3}} \right)\) từ khí nitơ và khí hiđro.
a) Viết phương trình hóa học
b) Số oxi hóa của các nguyên tố biến đổi như thế nào trong phản ứng hóa học đó?
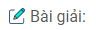
a) Phản ứng xảy ra:
Advertisements (Quảng cáo)
\({N_2} + 2{H_2}\,\, \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \,\,2N{H_3}\)
b) Số oxi hóa:
\(\mathop {{N_2}}\limits^0 + 2\mathop {{H_2}}\limits^0 \,\, \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \,\,2\mathop N\limits^{ – 3} \mathop {{H_3}}\limits^{ + 1} \)
Nitơ có số oxi hóa giảm từ 0 xuống -3. Còn hiđro có số oxi hóa tăng từ 0 lên +1.
loigiaihay.com
Bài 5: a) Viết phương trình hóa học của những biến đổi sau:
– Sản xuất vôi sống bằng cách nung đá vôi.
– Cho vôi sống tác dụng với nước (tôi vôi).
b) Số oxi hóa của các nguyên tố trong những phản ứng trên có biến đổi không?
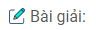
a) Các phản ứng hóa học:
– Phản ứng sản xuất vôi: \(\mathop {Ca}\limits^{ + 2} \mathop C\limits^{ + 4} \mathop {{O_3}}\limits^{ – 2} \,\,\buildrel {{{1000}^0}C} \over \longrightarrow \,\,\mathop {Ca}\limits^{ + 2} \mathop O\limits^{ – 2} + \mathop C\limits^{ + 4} \mathop {{O_2}}\limits^{ – 2} \)
– Phản ứng tôi vôi: \(\mathop {Ca}\limits^{ + 2} \mathop O\limits^{ – 2} + \mathop {{H_2}}\limits^{ + 1} \mathop O\limits^{ – 2} \,\, \to \,\,\mathop {Ca}\limits^{ + 2} {(\mathop O\limits^{ – 2} \mathop H\limits^{ + 1} )_2}\)
b) Trong các phản ứng trên không có sự thay đổi số oxi hóa.
Advertisements (Quảng cáo)
loigiaihay.com
Bài 6: Glixerol trinitrat là chất nổ đinamit. Đó là một chất lỏng có công thức phân tử \({C_3}{H_5}{O_9}{N_3},\) rất không bền, bị phân hủy tạo ra \(C{O_2},{H_2}O,{N_2}\) và \({O_2}.\)
a) Viết phương trình hóa học của phản ứng phân hủy glixerol trinitrat.
b) Hãy tính thể tích khí sinh ra làm nổ 1 kg chất nổ này. Biết rằng ở điều kiện phản ứng, 1 mol khí có thể tích là 50 lít.
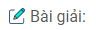
a) Phương trình phản ứng:
\(4{C_3}{H_5}{O_9}{N_{3\,\,\left( l \right)}}\,\,\mathop \to \limits^{{t^0}} \,\,12C{O_{2\,\,\left( K \right)}} + 10{H_2}{O_{\left( K \right)}} \)
\(+ 6{N_{2\,\,\left( K \right)}} + {O_{2\,\,\left( K \right)}}\)
b) Thể tích khí sinh ra:
Theo phản ứng: Cứ 4 mol glixerol trinitrat khi nổ tạo ra 29 mol chất khí.
Vậy 1kg glixerol trinitrat khi nổ tạo ra n mol chất khí.
\( \Rightarrow n = {{29.1000} \over {4.227}} = 31,94\,\,\left( {mol} \right)\)
\(\Rightarrow {V_{khi}} = 31,94 \times 50 \approx 1597\) (lít).
loigiaihay.com
Bài 7: Hợp chất A (không chứa clo) cháy được trong khí clo tạo ra nitơ và hiđro clorua.
a) Xác định công thức phân tử của khí A, biết rằng tỉ lệ giữa thể tích khí clo tham gia phản ứng và thể tích nitơ tạo thành là 3 : 1.
b) Viết phương trình hóa học của phản ứng giữa A và clo.
c) Tính số oxi hóa của tất cả các nguyên tố trước và sau phản ứng.
a) Xác định công thức khí A.
Sơ đồ phản ứng: \(A + C{l_2}\,\, \to \,\,{N_2} + 2HCl\).
Theo sơ đồ ta thấy: Cứ 1 thể tích Cl2 phản ứng tạo ra 2 thể tích khi HCl.
Từ tỉ lệ: \({V_{C{l_2}}}:{V_{{N_2}}} = 3:1 \Rightarrow {V_{HCl}}:{V_{{N_2}}} = 6:1.\)
Vậy trong phân tử A có 3 nguyên tố H và 1 nguyên tử N. Công thức phân tử của A là NH3.
b) Phản ứng: \(2N{H_3} + 3C{l_2}\,\, \to \,\,{N_2} + 6HCl.\)
c) Tính số oxi hóa: \(2\mathop N\limits^{ – 3} \mathop {{H_3}}\limits^{ + 1} + 3\mathop {C{l_2}}\limits^0 \,\, \to \,\,\mathop {{N_2}}\limits^0 + 6\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ – 1} .\)
loigiaihay.com
Bài 8: Cho ba thí dụ về phản ứng tỏa nhiệt và ba thí dụ về phản ứng thu nhiệt.
Ba thí dụ về phản ứng tỏa nhiệt \(\left( {\Delta H < 0} \right)\):
\(\eqalign{ & {C_{\left( r \right)}} + {O_{2\left( k \right)}}\,\, \to \,\,C{O_{2\left( k \right)}};\cr&\Delta H = – 393,5\,\,KJ/mol \cr & {\rm{CuS}}{O_{4\,\left( {dd} \right)}} + Z{n_{\left( r \right)}}\,\, \to \,\,ZnS{O_{4\,\,\left( {dd} \right)}} + C{u_{\left( r \right)}};\cr&\Delta H = – 231,04\,\,KJ/mol \cr & H{I_{\left( k \right)\,}}\,\, \to {1 \over 2}{H_{2\,\left( k \right)}} + {1 \over 2}{I_{2\,\left( k \right)}};\cr&\Delta H = – 25,9\,\,KJ/mol \cr} \)
Ba thí dụ về phản ứng thu nhiệt \(\left( {\Delta H > 0} \right):\)
\(\eqalign{ & {C_{\left( r \right)}} + {H_2}{O_k}\,\, \to \,\,C{O_{\left( k \right)}} + {H_{2\,\left( k \right)}};\cr&\Delta H = + 131,25\,\,KJ/mol \cr & {1 \over 2}{H_{2\,\left( k \right)}} + {1 \over 2}{I_{2\,\left( k \right)}}\,\, \to \,\,H{I_{\left( k \right)}};\cr&\Delta H = + 25,9\,\,KJ/mol \cr & CaC{O_{3\,\left( r \right)}}\,\, \to \,\,Ca{O_{\left( r \right)}} + C{O_{2\,\left( k \right)}};\cr&\Delta H = + 177,9\,KJ/mol \cr} \)
loigiaihay.com

