Bài 6: Bảng dưới đây cho biết bán kính nguyên tử và năng lượng ion hóa thứ nhất của nguyên tử một số nguyên tố.
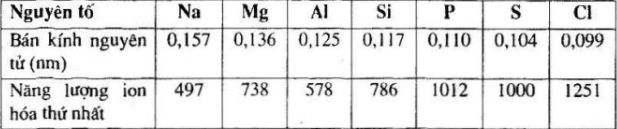
a) Sự biến đổi bán kính nguyên tử của các nguyên tố trong chu kì.Dựa vào các dữ kiện trên, hãy rút ra nhận xét sau:
b) Sự biến đổi năng lượng ion hóa \({I_1}\) của nguyên tử các nguyên tố trong chu kì.
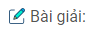
a) Trong một chu kì, từ trái sang phải, bán kính nguyên tử giảm dần.
b) Trong một chu kì, từ trái sang phải, năng lượng ion hóa \({I_1}\) tăng dần.
Bài 7: Phát biểu định luật tuần hoàn và cho biết nguyên nhân của sự biến đổi tuần hoàn tính kim loại, tính phi kim của các nguyên tố theo chiều tăng của điện tích hạt nhân nguyên tử.
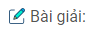
Định luật: “Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân ngu’yên tử”.
Nguyên nhân: Tính kim loại, tính phi kim của các nguyên tố phụ thuộc chủ yếu vào cấu hình electron nguyên tử của các nguyên tố trong bảng tuần hoàn có tính biến đổi tuần hoàn nên tính kim loại, tính phi kim biến đổi tuần hoàn.
Advertisements (Quảng cáo)
Bài 8: Nguyên tố clo thuộc chu kì 3 và nhóm VIIA, hãy cho biết đặc điểm về cấu hình elecron nguyên tử và tính chất hóa học cơ bản của clo.
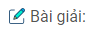
Cấu hình electron nguyên tử của clo: \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^5}\)
Tính chất hóa học cơ bản:
– Hóa trị cao nhất với oxi là 7, công thức oxit cao nhất \(C{l_2}{O_7}\).
– Hóa trị với hiđro là 1, công thức hợp chất khí với hiđro: HCl
Advertisements (Quảng cáo)
– Oxit \(C{l_2}{O_7}\) là oxit axit. Axit \(HCl{O_4}\) là axit rất mạnh.
Bài 9: Nguyên tố natri thuộc chu kì 3 và nhóm IA, hãy cho biết đặc điểm và cấu hình electron nguyên tử và tính chất hóa học cơ bản của natri.
Cấu hình electron nguyên tử của Na: \(1{s^2}2{s^2}2{p^6}3{s^1}.\)
Tính chất hóa học cơ bản:
– Là kim loại điển hình.
– Hóa trị cao nhất với oxi là 1, công thức oxit \(N{a_2}O\).
– Công thức hợp chất hiđroxit NaOH.
– Oxit và hiđroxit có tính chất bazơ mạnh.
Bài 10: Hãy so sánh tính kim loại của Mg (Z = 12) với Na(Z = 11) và Al(Z = 13).
Cấu hình electron nguyên tử của các nguyên tố:
\(\eqalign{
& Na\left( {Z = 11} \right)\,\,1{s^2}2{s^2}2{p^6}3{s^1} \cr
& Mg\left( {Z = 12} \right)\,\,1{s^2}2{s^2}2{p^6}3{s^2} \cr
& Al\left( {Z = 13} \right)\,\,1{s^2}2{s^2}2{p^6}3{s^2}3{p^1} \cr} \)
Nguyên tử của 3 nguyên tố trên đều có 3 lớp electronn nên chúng đều thuộc chu kì 3. Chúng lần lượt có số electron lớp ngoài cùng la 1, 2, 3 nên đều là những kim loại. Theo quy luật về sự biến đổi tính kim loại-phi kim, Mg có tính kim loại yếu hơn Na nhưng mạnh hơn Al.

