Bài 44.1: Cân 10,6 g muối Na2CO3 cho vàồ cốc chia độ. Rót vào cốc khoảng vài chục mililít nước cất, khuấy cho muối tan hết. Sau đó rót thêm nước vào cốc cho đủ 200 ml. Ta được dung dịch Na2CO3 có khối lượng riêng là 1,05 g/ml. Hãy tính nồng độ phần trăm và nồng độ mol của dung dịch vừa pha chế.

Nồng độ phần trăm của dung dịch pha chế:
– Khối lượng của dung dịch Na2CO3 :
\({m_{{\rm{dd}}}} = 1,05 \times 200 = 210(g)\)
– Nồng độ phần trăm của dung dịch
\(C\% = {{100\% \times 10,6} \over {210}} \approx 5,05\% \)
Nồng độ mol của dung dịch pha chế:
– Số mol Na2CO3 trong dung dịch:
\({n_{N{a_2}C{O_3}}} = {{10,6} \over {106}} = 0,1(mol)\)
– Nồng độ mol của dung dịch :
\({C_M} = {{1000 \times 0,1} \over {200}} = 0,5(mol/l)\).
Bài 44.2: Có : CuSO4 và nước cất. Hãy tính toán và trình bày cách pha chế để có được những sản phẩm sau :
a) 50 ml dung dịch CuSO4 có nồng độ IM.
b) 50 g dung dịch CuSO4 có nồng độ 10%.
Advertisements (Quảng cáo)

a) Pha chế 50 ml dung dịch CuSO4 1M :
– Số mol CuSO4 cần dùng là :
\({n_{CuS{O_4}}} = {{1 \times 50} \over {1000}} = 0,05(mol)\, có khối lượng là:
\({m_{CuS{O_4}}} = 160 \times 0,05 = 8(g)\)
– Cách pha chế:
Cân 8 g CuSO4 cho vào cốc chia độ. Thêm khoảng 25 – 30 ml nước cất vào cốc, dùng đũa thuỷ tinh khuấy cho CuSO4 tan hết, bỏ đũa ra ngoài, thêm từ từ nước cất cho đủ 50 ml. Trộn đều, ta được 50 ml dung dịch CuSO4 có nồng độ 1M.
b) Pha chế 50 g dung dịch CuSO4 10% :
– Khối lượng CuSO4 cần dùng là :
\({m_{CuS{O_4}}} = {{10 \times 50} \over {100}} = 5(g)\)
Advertisements (Quảng cáo)
– Khối lượng nước cất cần dùng là :
50-5 = 45 (g)
-Cách pha chế:
Cân lấy 5 g CuSO4 cho vào cốc. Rót từ từ vào cốc 45 g hoặc 45 ml nước cất, khuấy cho CuSO4 tan hết, ta được 50 g dung dịch CuSO4 10%.
Bài 44.3: Bảng dưới đây cho biết độ tan của một muối trong nước thay đổi theo nhiệt độ :
|
Nhiệt độ (°C) |
20 |
30 |
40 |
50 |
60 |
|
Độ tan (g/100 g nước) |
5 |
11 |
18 |
28 |
40 |
a) Vẽ đồ thị biểu diễn độ tan của muối trong nước (trục tung biểu thị khối lượng chất tan, trục hoành biểu thị nhiệt độ).
b) Căn cứ vào đồ thị, hãy ước lượng độ tan của muối ở 25°c và 55°C
c) Tính số gam muối tan trong :
– 200 g nước để có dung dịch bão hoà ở nhiệt độ 20°C.
– 2 kg nước để có dung dịch bão hoà ờ nhiệt độ 50°C.

a) Xem đồ thị
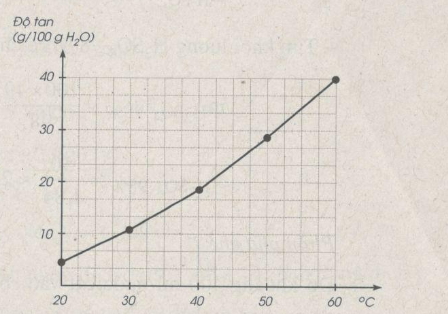
b) Ước lượng độ tan của muối:
\({S_{{{25}^o}C}} \approx 7,5g/100g{H_2}O\)
\({S_{{{55}^o}C}} \approx 32g/100g{H_2}O\)
c) Khối lượng muối có trong các dung dịch bão hòa:
– Ở nhiệt độ 20°C : Độ tan của muối là 5 g, suy ra trong 200 g nước có khối lượng muối tan là
\({{5 \times 200} \over {100}} = 10(g)\)
– Ở nhiệt độ 50°C : Độ tan của muối là 28 g, suy ra trong 2 kg (2000 g) nước có khối lượng muối tan là :
\({{28 \times 2000} \over {100}} = 560(g)\)
Bài 44.4: Người ta pha chế một dung dịch NaCl ở 20°C bằng cách hoà tan 23,5 g NaCl trong 75 g nước. Căn cứ vào độ tan của NaCl trong nước \({S_{NaCl({{20}^o}C)}} = 32g\), hãy cho biết dung dịch NaCl đã pha chế là bão hoà hay chưa bão hoà. Nếu dung dịch NaCl là chưa bão hoà, làm thế nào để có được dung dịch NaCl bão hoà ở 20°C ?

Theo độ tan của muối NaCl trong nước ở nhiệt độ 20°C là 32 g, ở nhiệt độ này 75 g nước hoà tan tối đa được :
\({{32 \times 75} \over {100}} = 24(g)\)
Như vậy, dung dịch NaCl đã pha chế là chưa bão hoà. Để có được dung dịch NaCl bão hoà ở nhiệt độ này, ta cho thêm vào dung dịch đã pha chế một khối lượng NaCl là :
24 – 23,5 = 0,5 (g)
Khuấy cho muối tan hết, ta được dung dịch bão hoà NaCl ở 20 °C.

