Bài 6.7: Hỗn hợp khí A chứa một ankan và một anken, Khối lượng hỗn hợp A là 9 gam và thể tích là 8,96 lít. Đốt cháy hoàn toàn A, thu được 13,44 lít C02. Các thể tích được đo ở đktc. Xác định công thức phân tử và phần trăm thể tích từng chất trong A.
Cách 1.
Giả sử hỗn hợp A có x mol CnH2n+2 và y mol CmH2m
x + y = \(\frac{{8,96}}{{22,4}}\) = 0,4 (1)
(14n + 2)x + 14my = 9 (2)
\({C_n}{H_{2n + 2}} + \frac{{3n + 1}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
x mol nx mol
\({C_m}{H_{2m}} + \frac{{3m + 1}}{2}{O_2} \to mC{O_2} + m{H_2}O\)
y mol my mol
nx + ny = \(\frac{{13,44}}{{22,4}}\) = 0,6 (3)
Từ (2) và (3), dễ dàng tìm được x = 0,3 ; suy ra y = 0,1.
Thay hai giá trị đó vào (3) tìm được :
0,3n + 0,1m = 0,6
3n + m = 6 \( \Rightarrow n = 2 – \frac{m}{3}\)
Nghiệm nguyên thu được là m = 3, n = 1
CH4 chiếm 75,0% thể tích A và C3H6 chiếm 25,0%.
Cách 2.
Khối lượng trung bình của 1 mol A :
\({\overline M _A} = \frac{9}{{0,4}}\) = 22,5(g/mol)
Trong hỗn hợp A phải có chất có M < 22,5 ; chất đó chỉ có thể là CH4.
Advertisements (Quảng cáo)
Sau đó giải hệ
\(\left\{ \begin{array}{l}
x + y = 0,4\\
16{\rm{x}} + 14my = 9\\
x + my = 0,6
\end{array} \right.\)
tìm được m = 3 ; x = 0,3 ; y = 0,1.
Bài 6.8: 0,7 g một anken có thể làm mất màu 16,0 g dung dịch brom (trong CCl4) có nồng độ 12,5%.
1. Xác định công thức phân tử chất A.
2. Viết công thức cấu tạo của tất cả các đồng phân cấu tạo ứng với công thức phân tử tìm được. Ghi tên từng đồng phân.
1. \({C_n}{H_{2n}} + B{{\rm{r}}_2} \to {C_n}{H_{2n}}B{{\rm{r}}_2}\)
Số mol anken = số mol Br2 = \(\frac{{16.12,5}}{{100.160}}\) = 0.0125 (mol).
Khối lượng 1 mol anken = \(\frac{{0,7}}{{0,0125}}\) = 56 (g).
14n = 56 \( \Rightarrow \) n = 4 \( \Rightarrow \) C4H8.
2. CH2 = CH – CH2 – CH3 ; CH3 – CH = CH – CH3
but-1-en but-2-en
Advertisements (Quảng cáo)
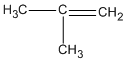

2-metylpropen xiclobutan
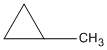
metylxiclopropan
Bài 6.9: Hỗn hợp khí A chứa eten và hiđro. Tỉ khối của A đối với hiđro là 7,5. Dẫn A đi qua chất xúc tác Ni nung nóng thì A biến thành hỗn hợp khí B có tỉ khối đối với hiđro là 9.
Tính hiệu suất phản ứng cộng hiđro của eten.
Giả sử trong 1 mol hỗn hợp A có x mol C2H4 và (1 – x) moỉ H2.
MA = 28x + 2(1 – x) = 7,5.2 = 15 (g/mol) ;
\( \Rightarrow \) x = 0,5.
Giả sử khi dẫn 1 mol A qua chất xúc tác Ni, có n mol \({C_2}{H_4}\) tham gia phản ứng :
C2H4 + H2 \( \Rightarrow \) C2H6
n mol n mol n mol
Số mol khí còn lại trong hỗn hợp B là (1 – n) mol. Theo định luật bảo toàn khối lượng :
mB = mA= 15 g.
Khối lượng của 1 mol B : MB = \(\frac{{15}}{{1 – n}}\) = 9.2 = 18(g/mol) \( \Rightarrow \) n = 1
Hiệu suất phản ứng : H = \(\frac{1}{{6.0,5}}\). 100% = 33,33%.
Bài 6.10: Hỗn hợp khí A chứa hiđro và một anken. Tỉ khối của A đối với hiđro là 6,0. Đun nóng nhẹ hỗn hợp A có mặt chất xúc tác Ni thì A biến thành hỗn hợp khí B không làm mất màu nước brom và có tỉ khối đối với hiđro là 8
Xác định công thức phân tử và phần trăm thể tích của từng chất trong hỗn hợp A và hỗn hợp B.
Giả sử trong 1 mol A có x mol CnH2n và (1 – x) mol H2.
MA = 14nx + 2(1 – x) = 2.6 = 12 (g/mol) (1)
Khi đun nóng 1 mol A có mặt chất xúc tác Ni, tất cả anken đã chuyển hết thành ankan (vì B không làm mất màu nước brom).
\({C_n}{H_{2n}} + {H_2} \to {C_n}{H_{2n + 2}}\)
x mol x mol x mol
Số mol khí trong hỗn hợp B là (1 – x)
Khối lượng hỗn hợp B = khối lượng hỗn hợp A = 12 (g). Do đó :
MB= \(\frac{{12}}{{1 – x}}\) = 8.2 = 16(g/mol) \( \Rightarrow \) x = 0,25.
Thay x = 0,25 vào (1), tìm được n = 3.
Hỗn hợp A : C3H6 25% ; H2 : 75%.
Hỗn hơp B : \({C_3}{H_8}:\frac{{0,25}}{{0,75}}\). 100% = 33,33%
H2 : 66,67%.

