Bài 6.36: Đốt cháy hoàn toàn 3,4 gam hợp chất A, thu được 2,24 lít khí \(SO_2\) (đktc) và 1,8 gam \(H_2O\).
a) Hãy xác định công thức phân tử của hợp chất A.
b) Viết PTHH biểu diễn phản ứng cháy của hợp chất A.
c)Dẫn khí \(SO_2\) thu được ở trên vào 146,6 gam dung dịch, trong đó có hoà tan 0,3 mol NaOH. Hãy xác định nồng độ phần trăm các chất có trong dung dịch sau phản ứng.
a) Công thức phân tử của hợp chất A :
Sô mol các sản phẩm của phản ứng :
\(nSO_2\) = 0,1 mol ; \(nH_2O\) = 0,1 mol.
Khối lượng của hiđro có trong 0,1 moi \(H_2O\) (2 g.0,1 = 0,2 g) và khối lượng của lưu huỳnh có trong 0,1 mol \(SO_2\) (32 g.0,1 = 3,2 g) đúng bằng khối lượng của hợp chất A đem đốt (3,4 g).
Vậy thành phần của hợp chất A chỉ có 2 nguyên tố là H và S.
– Tỉ lệ giữa số mol nguyên tử H và số mol nguyên tử S là :
\(n_H:n_S =0,1.2 : 0,1 =2 : 1\)
Công thức phân tử của hợp chất A là : \(H_2S\).
b) PTHH của phản ứng đốt cháy \(H_2S\) :
\(2H_2S + 3O_2 → 2SO_2 + 2H_2O\)
c) Nồng độ phần trăm của các chất trong dung dịch :
Biết số mol NaOH (0,3 mol) nhiều hơn 2 lần số mol \(SO_2\) (0,1 mol), vậy sản phẩm là muối \(Na_2SO_3\). Ta có PTHH :
Advertisements (Quảng cáo)
\(SO_2 + 2NaOH → Na_2SO_3 + H_2O\)
– Khối lượng của dung dịch sau phản ứng :
\(m_{dd}\) = 146,6 + 3,4 = 150 (g)
– Khối lượng các chất có trong dung dịch sau phản ứng :
\(m_{Na_2SO_3}\)= 126.0,1 = 12,6 (g) \(Na_2SO_3\)
\(m_{NaOHdư}\)= 40.(0,3 – 0,2) = 4 (g) NaOH
– Nồng độ phần trăm các chất trong dung dịch sau phản ứng :
\(C{\% _{N{a_2}S{O_3}}} = {{12,6} \over {150}}.100\% = 8,4\% \)
\(C{\% _{NaOH\,dư}} = \frac{4}{{150}}.100\% \approx 2,67\% \)
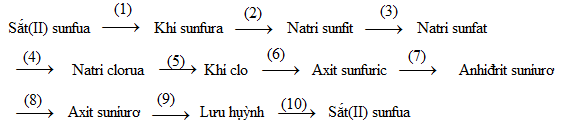
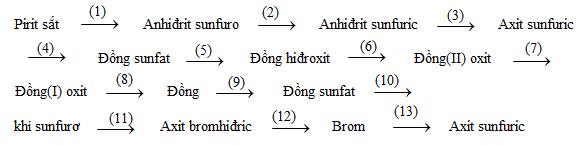
Bài 6.37: Viết phương trình hoá học của các phản ứng, hoàn thành chuỗi biến hoá sau :
Advertisements (Quảng cáo)
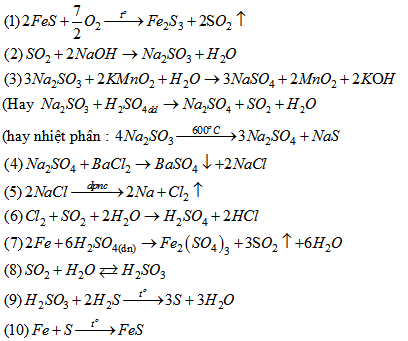
Bài 6.38: Viết phương trình hoá học của các phản ứng, thực hiện chuỗi biến đổi sau
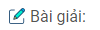
Bài 6.39
Viết PTHH của chuỗi phản ứng sau :
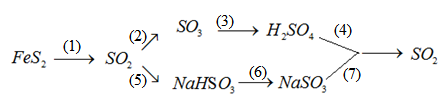
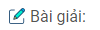
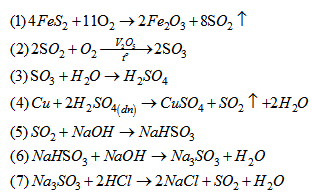
Bài 6.40
a) Tại sao dung dịch \(H_2S\) trong nước để lâu ngày trở nên vẩn đục ?
b)Hãy giải thích vì sao trong tự nhiên có nhiều nguồn phóng thải ra khí \(H_2S\) (núi lửa, xác động vật bị phân huỷ) nhưng lại không có sự tích tụ khí đó trong không khí ?
c) Hãy giải thích vì sao các đồ vật bằng bạc để lâu ngày thường bị xám đen ?
d) Tại sao người ta có thể nhận biết khí \(H_2S\) bằng tờ giấy tẩm dung dịch \(Pb(NO_3)_2\) ?
a) Dung dịch \(H_2S\) để lâu ngày bị vẩn đục do bị \(O_2\) trong không khí oxi hoá giải phóng ra không tan trong nước
\(2H_2S + O_2 →2S↓ + 2H_2O\)
b) Do khí \(H_2S\) có tính khử mạnh nên nó tác dụng luôn với các chất oxi hoá như \(O_2\) của không khí hoặc \(SO_2\) có trong khí thải của các nhà máy.
c) Do bạc tác dụng với \(O_2\) và khí \(H_2S\) có trong không khí tạo ra bạc sunfua có màu xám đen.
\(4Ag + O_2+ 2H_2S → 2Ag_2S +2H_2O\)
màu xám đen
d) Nhận biết được khí \(H_2S\) bằng dung dịch \(Pb(NO_3)_2\) do phản ứng tạo ra chất kết tủa màu đen.
\(H_2S + Pb(NO_3)_2 → PbS ↓ + 2HNO_3\)
màu đen

