[Bài 32 Hóa 10] Hiđro Sunfua – Lưu huỳnh đioxit – Lưu huỳnh trioxit: Giải bài 1, 2, 3, 4 trang 138; bài 5, 6, 7, 8, 9, 10 trang 139 SGK Hóa 10.
Bài 1. Lưu huỳnh đioxit có thể tham gia các phản ứng sau :
SO2 + Br2 + 2H2O -> 2HBr + H2SO4 (1)
SO2 + 2H2O -> 3S + 2H2O (2)
Câu nào diễn tả không đúng tính chất hóa học của các chất trong những phản ứng trên ?
A.Phản ứng (1) : SO2 là chất khử, Br2 là chất oxi hóa.
B. Phản ứng (2) : SO2 là chất oxi hóa, H2S là chất khử.
C. Phản ứng (3) : SO2 vừa là chất khử, vừa là chất oxi hóa.
D. Phản ứng (1) : Br2 là chất oxi hóa, phản ứng (2) : H2S là chất khử.
Đáp án C.
Bài 2. Hãy ghép cặp chất và tính chất sao cho phù hợp :
Các chất Tính chất của chất
A. S a) chỉ có tính oxi hóa
B. SO2 b) chỉ có tính khử
C. H2S c) có tính oxi hóa và tính khử.
D. H2SO4 d) chất khí, có tính oxi hóa và tính khử
e) không có tính oxi hóa và tính khử.
Đáp án: A với c) ; B với d) ; C với b) ; D với a).
Bài 3. Cho phản ứng hóa học :
H2S + 4Cl2 + 4H2O -> H2SO4 + 8HCl
Câu nào sau đây diễn tả đúng tính chất các chất phản ứng ?
A. H2S là chất oxi hóa, Cl2 là chất khử.
B. H2S là chất khử, H2O là chất oxi hóa.
C. Cl2 là chất oxi hóa, H2O là chất khử.
D. Cl2 là chất oxi hóa, H2S là chất khử.
Đáp án D.
Bài 4: Hãy cho biết tính chất hóa học đặc trưng của
a) Hiđro sunfua.
b) lưu huỳnh đioxit.
Dẫn ra những phản ứng hóa học để minh họa.
Giải: a) Tính chất hóa học của hiđro sunfua:
– Hiđro sunfua tan trong nước thành dung dịch axit rất yếu.
– Tính khử mạnh :
H2S + O2 -tº→ 2S + 2H2O.
H2S + 3O2 -tº→ 2SO3 + 2H2O
b) Tính chất hóa học của lưu huỳnh đioxit
– Lưu huỳnh đioxit là một oxit axit :
+ SO2 tan trong nước thành dung dịch axit H2SO3, là axit yếu:
SO2 + H2O -> H2SO3
+ SO2 tác dụng với dung dịch bazơ, tạo nên hai muối :
Advertisements (Quảng cáo)
SO2 + NaOH -> NaHSO3.
SO2 + 2NaOH -> Na2SO3 + H2O.
– Lưu huỳnh đioxit là chất khử và là chất oxi hóa
SO2 + Br2 + 2 H2O -> 2HBr + H2SO4
2 SO2 + 3H2S -> 2S + 2H2O.
Bài 5: Dẫn khí SO2 vào dung dịch KMnO4 màu tím nhận thấy dung dịch bị mất màu, vì xảy ra phản ứng hóa học sau :
SO2 + KMnO4 + H2O -> K2SO4 + MnSO4 + H2SO4
a) Hãy cân bằng phương trình hóa học trên bằng phương pháp thăng bằng electron.
b) Hãy cho biết vai trò của SO2 và KMnO4 trong các trường hợp trên.
Giải bài 5:
a) Cân bằng phương trình hóa học:
b) SO2 là chất khử, KMnO4 là chất oxi hóa.
Bài 6. a)Bằng phản ứng hóa học nào có thể chuyển hóa lưu huỳnh thành lưu huỳnh đioxit và ngược lại lưu huỳnh đioxit thành lưu huỳnh ?
b) Khí lưu huỳnh đioxit là khí chủ yếu gây mưa axit. Mưa axit phá hủy những công trình được xây dựng bằng đá, thép.
Tính chất nào của SO2 đã hủy hoại những công trình này ? Hãy dẫn ra những phản ứng hóa học để chứng minh.
Giải bài 6: a) S + O2 -> SO2 (dựa vào tính khử của S).
SO2 + H2S -> 3S + 2H2O (dựa vào tính oxi hóa của SO2).
b) Tính khử của SO2.
SO2 do nhà máy thải vào khí quyển. Nhờ xúc tác là oxit kim loại trong khói bụi nhà máy, nó bị O2 của không khí oxi hóa thành SO3
2SO2 + O2 -> 2SO3
SO3 tác dụng với nước mưa tạo thành mưa axit tạo ra H2SO4. Tính axit của H2SO4 đã phá hủy những công trình được xây dựng bằng đá, thép.
Bài 7.Hãy dẫn ra những phản ứng hóa học chứng minh rằng lưu huỳnh đi oxit và lưu huỳnh trioxit là những oxit axit.
Giải bài 7: SO2 và SO3 là các oxit axit vì:
– SO2 và SO3 tan trong nước tạo thành dung dịch axit.
Advertisements (Quảng cáo)
SO2 + H2O ⇔ H2SO3
SO3 + H2O -> H2SO4
SO2 và SO3 tác dụng với bazơ , oxit bazơ để tạo muối sunfit và sunfat.
SO2 + NaOH -> NaHSO3
SO2 + 2NaOH -> Na2SO3 + H2O
SO3 + NaOH -> NaHSO4
SO3 + 2NaOH -> Na2SO4 + H2O.
SO2 + CaO -> CaSO3
SO3 + MgO -> MgSO4.
Bài 8 trang 139 Hóa học 10: Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl (dư), thu được 2,464 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch Pb(NO3)2 (dư) thu được 23,9 gam kết tủa màu đen.
a) Viết các phương trình phản ứng.
b) Hỗn hợp khí thu được gồm những khí nào ? Thể tích mỗi khí là bao nhiêu (đktc) ?
c) Tính khối lượng của Fe và Fe trong hỗn hợp ban đầu.
Giải bài 8: a) Phương trình hóa học của phản ứng.
Fe + 2HCl -> FeCl2 + H2
x mol x mol.
FeS + 2HCL -> FeCl2 + H2S
ymol y mol
H2S + Pb(NO3)2 -> PbS + 2HNO3
0,1 0,1
b) Ta có nhh khí = 2,464 / 22,4 = 0,11 (mol),
nPbS
=23,9/239 = 0,1 (mol).
Hỗn hợp khí thu được là H2 và H2S.
Theo phương trình phản ứng hóa học trên ta có : 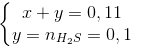
=> x = 0,01 (mol).
Vậy VH2 = 0,01. 22,4 = 0,224 (lít),
VH2s = 0,1. 22,4 = 2,24 (lít).
c) mFe = 56.0,01 = 0,56g ; mFeS = 0,1.88 = 8,8g.
Bài 9 trang 139 Hóa 10: Đốt cháy hoàn toàn 2,04 gam hợp chất A, thu được 1,08 g H2O và 1,344 l SO2 (đktc).
a) Hãy xác định công thức phân tử của hợp chất A.
b) Dẫn toàn bộ lượng hợp chất A nói trên qua dung dịch axit sunfuric đặc thấy có kết tủa màu vàng xuất hiện :
– Hãy giải thích hiện tượng và viết các phương trình phản ứng xảy ra.
– Tính khối lượng kết tủa thu được.
Hướng dẫn bài 9:
a) Xác định công thức phân tử của hợp chất A.
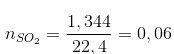 => mS = 1,92 gam
=> mS = 1,92 gam
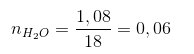 => mH = 0,12 gam.
=> mH = 0,12 gam.
Như vậy hợp chất A chỉ gồm hai nguyên tố H và S.
Đặt công thức của hợp chất A là HxSy.
Ta có tỉ lệ y : x = 0,06 : 0,12 = 1 : 2.
Vậy công thức phân tử của A là H2S.
b) Phương trình hóa học của phản ứng.
3H2S + H2SO4 -> 4S + 4H2O
0,06 -> 0,08 (mol)
![]() (mol)
(mol)
Vậy mS = 0,08.32 = 2,56g.
Bài 10 trang 139 Hóa 10: Hấp thụ hoàn toàn 12,8g SO2 vào 250 ml dung dịch NaOH 1M.
a) Viết các phương trình hóa học của các phản ứng có thể xảy ra.
b) Tính khối lượng muối tạo thành sau phản ứng.
Hướng dẫn: a) Các phản ứng có thể xảy ra:
SO2 + NaOH –> NaHSO3 (1)
NaHSO3 + NaOH –> Na2SO3 + H2O (2)
b) Số mol SO2: nSO2 = 12,8 /64 = 0,2 mol
Số mol NaOH: nNaOH = 1. 0,25 = 0,25 (mol) Vậy sau phản ứng thứ nhất thì NaOH còn dư nó sẽ tác dụng tiếp với NaHSO3 theo phản ứng thứ hai
Từ (1) ta có nNaHSO3 = 0,2 mol
Theo (2) ta có 0,05 mol NaHSO3 tác dụng với 0,05 mol NaOH dư tạo ra 0,05 mol Na2SO3
Số mol các chất còn lại sau phản ứng (2)
nNa2SO3 = 0,05 (mol)
nNaHSO3 còn lại = 0,15 mol
Khối lượng các muối thu được:
mNaHSO3 = 0,15 . 104 = 15,6 (g)
mNa2SO3 = 0,05 . 126 = 6,3 (g)


