Bài 30 : Lưu Huỳnh – Chương 6 Hóa 10: Giải bài 1, 2,3,4,5 trang 132 SGK Hóa 10.
Bài 1: Lưu huỳnh tác dụng với axit sulfuric đặc nóng :
S + H2SO4 -> 3SO2 + 2H2O
Trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử : số lưu huỳnh bị oxi hóa là
A. 1 : 2.
B. 1 : 3.
C. 3 : 1.
D. 2 : 1.
Đáp án D.
Bài 2 trang 132: Đơn chất nào sau đây vừa có tính oxi hóa, vừa có tính khử ?
A. Cl2, O3, S.
B. S, Cl2, Br2.
C. Na, F2, S.
D. Br2, O2, Ca.
Đáp án B.
Bài 3 trang 132: Có thể dự đoán sự thay đổi như thế nào về khối lượng riêng, về nhiệt độ nóng chảy khi giữ lưu huỳnh đơn tà (Sß) dài ngày ở nhiệt độ phòng ?
Advertisements (Quảng cáo)
Giải bài 3: Ở nhiệt độ phòng, có sự chuyển hóa từ Sß → Sα vì vậy khi giữ Sß vài ngày ở nhiệt độ phòng thì :
– Khối lượng riêng của lưu huỳnh tăng dần.
– Nhiệt độ nóng chảy thấp hơn.
Bài 4 trang 132 Hóa 10: Đun nóng một hỗn hợp gồm có 0,65g bột kẽm và 0,224 g bột lưu huỳnh trong ống nghiệm đậy kín không có không khí. Sau phản ứng, người ta thu được chất nào trong ống nghiệm ? Khối lượng là bao nhiêu ?

Phương trình hóa học của phản ứng:
Zn + S -> ZnS
0,07 0,07 0,07 (mol)
Khối lượng các chất sau phản ứng:
Advertisements (Quảng cáo)
mZn(dư) = (0,01 -0,007).65 = 0,195 gam.
mZnS = 0,007.97 = 0,679g.
Bài 5 trang 132 Hóa 10: 1,10g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28g bột lưu huỳnh.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu, theo :
– Lượng chất.
– Khối lượng chất.
Giải: a)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có nS =1,28/32 = 0,04 (mol).
Ta có hệ phương trình :
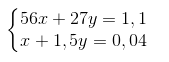
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl = 0,54/1,1 . 100 = 49,09%.
%mFe = 50,91 %.
Theo lượng chất :
%nAl = 66,67%.
%Fe = 33,33%.

