Bài 7.36: Gần đây, khi thám hiểm Nam Cực, các nhà khoa học đã tìm thấy những đồ hộp do các đoàn thám hiểm trước để lại. Mặc dù đã qua hàng trăm năm, nhưng các thức ăn trong những đồ hộp đó vẫn trong tình trạng tốt, có thể ăn được. Hãy giải thích và liên hệ với viộc bảo quản thực phẩm bằng cách ướp đá.
Nam Cực là nơi lạnh nhất Trái Đất. Nhiệt độ ở vùng này có thể xuống hàng chục độ dưới không. Ở nhiệt độ đó, các phản ứng hoá học phân huỷ thức ăn hầu như không xảy ra. Điều này giải thích vì sao đã qua hàng trăm năm, nhưng các thức ăn trong những đồ hộp đó vẫn trong tình trạng tốt, có thể ăn được. Để giảm tốc độ phản ứng phân huỷ thức ăn, người ta bảo quản thực phẩm bằng cách ướp đá.
Bài 7.37: Trong phòng thí nghiệm, để tăng tốc độ của một số phản ứng hoá học, ngoài các biện pháp như tăng nồng độ, nhiệt độ, người ta còn dùng máy khuấy. Tác dụng của máy khuấy là gì ?
Máy khuấy là một thiết bị cho phép tăng tốc độ khuếch tán của các chất tham gia phản ứng, do đó tăng khả năng tiếp xúc của các chất và tăng tốc độ phản ứng hoá học. Người ta thường dùng máy khuấy trong trường hợp phản ứng giữa các chất lỏng khác nhau, hay phản ứng giữa chất lỏng và chất rắn.
Bài 7.38: Làm thế nào để điều khiển các phản ứng hoá học theo hướng có lợi nhất cho con người ?
Trước hết cần biết rõ đặc điểm của phản ứng hoá học :
+ Phản ứng một chiều hay thuận nghịch ?
+ Phản ứng thu nhiệt hay toả nhiệt ?
+ Phản ứng có sự tăng thể tích khí hay giảm thể tích khí ?
+ Phản ứng cần chất xúc tác hay không ?
Advertisements (Quảng cáo)
+….
Căn cứ vào đặc điểm của phản ứng để tác động theo hướng tăng tốc độ phản ứng, chuyển dịch cân bằng theo chiều có lợi nhất.
Bài 7.39: Nồng độ các chất tham gia phản ứng có ảnh hưởng như thế nào đến tốc độ phản ứng khi các chất sau đây tác dụng với nhau ?
\(\begin{array}{l}
a)\,CaC{O_3} + HCl \to \\
b)\,{H_2} + C{l_2} \to \\
c)\,F{e_3}{O_4} + {H_2} \to
\end{array}\)
a) \(CaCO_3 + 2HCL → CaCl_2 + CO_2 + H_2O\)
Khi dung dịch HCL có nồng độ càng lớn thì tốc độ phản ứng càng lớn.
Advertisements (Quảng cáo)
b) \(H_2 + Cl_2 → 2HCL\)
Khi nồng độ (áp suất) các khí càng lớn thì tốc độ phản ứng càng lớn.
c) \(Fe_3O_4 + 4H_2 → 3Fe + 4H_2O\)
Chỉ có nồng độ (áp suất) của H2 ảnh hưởng đến tốc độ phản ứng vì \(Fe_3O_4\) là chất rắn. Nồng độ (áp suất) của \(H_2\) tăng thì tốc độ phản ứng tăng
Bài 7.40: Cho phản ứng :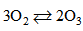 Nồng độ ban đầu của \(O_2\) là 0,24 mol/lít, sau 5 giây, nồng độ của \(O_2\) còn là 0,O_2 mol/lít. Hãy tính tốc độ của phản ứng trong thời gian đó.
Nồng độ ban đầu của \(O_2\) là 0,24 mol/lít, sau 5 giây, nồng độ của \(O_2\) còn là 0,O_2 mol/lít. Hãy tính tốc độ của phản ứng trong thời gian đó.
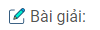
Tốc độ phản ứng : \(V = {{0,O_24 – 0,O_2} \over 5} = 0,008mol/l.s\)
Bài 7.41: Thực hiện phản ứng tổng hợp amoniac : 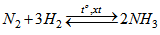
Nồng độ mol ban đầu của các chất như sau :
[\(N_2\)] = 1 mol/1 ; [\(H_2\)] = 1,2mol/l
Khi phản ứng đạt cân bằng nồng độ mol của [\(NH_3\)] = 0,2 mol/1. Tính hiệu suất của phản ứng tổng hợp amoniac.
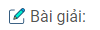
N2 + 3H2 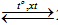 2NH3
2NH3
Ban đầu: 1mol/l 1,2mol/l
Cân bằng: — 0,3 mol/l 0,2 mol/l
Theo PTHH thì 1 mol \(N_2\) cần 3 mol \(H_2\). Ở đây chỉ có 1,2 mol \(H_2\), vì \(H_2\) thiếu nên tác dụng hết. Hiệu suất phải tính theo lượng chất tác dụng hết. Số mol \(H_2\) đã tác dụng là 0,3 mol.
Vậy h = (0,3 : 1,2). 100 = 25
Đáp số : h = 25%.

