Bài 32 Hiđro sunfua – Lưu huỳnh đioxit – Lưu huỳnh trioxit SBT Hóa lớp 10. Giải bài 6.41, 6.42, 6.43, 6.44, 6.45, 6.46 trang 66, 67 Sách bài tập Hóa học 10. Câu 6.41: Viết PTHH của các phản ứng của…
Bài 6.41 a) Viết PTHH của các phản ứng của \(H_2S\) với \(O_2, SO_2\) nước clo. Trong các phản ứng đó, \(H_2S\) thể hiện tính khử hay tính oxi hoá, vì sao ?
b)Có thể điều chế lưu huỳnh từ khí \(SO_2\) và \(H_2S\). Viết PTHH của phản ứng.
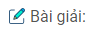
a)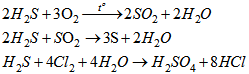
trong các phản ứng trên , \(H_2S\) thể hiện tính khử.
b) \(2H_2S+ SO_2→ 3S+2H_2O\)
Bài 6.42: Trong phản ứng hoá học, các chất : \(S, H_2S, SO_2, H_2SO_3 \)có thể đóng vai trò chất oxi hoá hay chất khử ? Hãy viết PTHH của phản ứng để minh hoạ cho mỗi trường hợp.
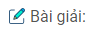
Các chất có thể đóng vai trò chất oxi hoá là \(S, SO_2, H_2SO_3\). Thí dụ :
a) \(S + 2Na → Na_2S\)
b) \(SO_2 + 2H_2S → 3S + 2H_2O\)
c) \(H_2SO_3 + 2H_2S  3S + 3H_2O\)
3S + 3H_2O\)
Các chất có thể đóng vai trò chất khử là \(S, H_2S, SO_2, H_2SO_3\). Thí dụ :
a) \(S + O_2 → SO_2\)
Advertisements (Quảng cáo)
b) \(H_2S + Cl_2→ S + 2HCL\)
c) \(SO_2 + Br_2 + 2H_2O → H_2SO_4 + 2HBr\)
d) \(5H_2SO_3 + 2KMnO_4 → 2H_2SO_4 + K_2SO_4 + 2MnSO_4 + 3H_2O\)
Bài 6.43: Cho m gam hỗn hợp hai muối \(Na_2CO_3\) và \(NaHSO_3\) có số mol bằng nhau tác dụng với dung dịch \(H_2SO_4\) loãng, dư. Khí sinh ra được dẫn vào dung dịch \(Ba(OH)_2\) dư thu được 41,4 gam kết tủa. Xác định m.
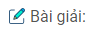
Ta thấy :\( n_{CO_2}\) = \(n_{SO_2}\) . Gọi \(XO_2 = (CO_2 + SO_2)\)
\( \Rightarrow X + 32 = {{44 + 64} \over 2} \Rightarrow X = 22\) (công thức tính PTK trung bình)
→ \(n_{BaXO_3↓}\)=0,2 mol
Khi đó : \(XO_2 +Ba(OH)_2 → BaXO_3 ↓ +H_2O\)
Advertisements (Quảng cáo)
(mol) 0,2 0,2
\(\Rightarrow {n_{C{O_2}}} = {n_{S{O_2}}} = 0,1 \Rightarrow {n_{N{a_2}C{O_3}}} = {n_{NaHC{O_3}}} = 0,1\,mol \Rightarrow m = 21\,gam\)
Bài 6.44; Dẫn từ từ 28 gam hỗn hợp X gồm (\(CO_2, SO_2\)), (\(d_{X/O_2}\) = 1,75) qua 500 ml dung dịch hỗn hợp (NaOH 0,7M ; \(Ba(OH)_2\) 0,4M) được m gam kết tủa. Xác định m.
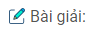
Ký hiệu: \(CO_2\) và \(SO_2\) là \(YO_2\) (
\({n_{Y{{\rm{O}}_2}}} = 0,5\,mol;\sum {{n_{OH}}} = 0,75\,mol;\,\,{n_{B{a^{2 + }}}} = 0,2\,mol\)
Ta có: \(1 < {{{n_{O{H^ – }}}} \over {{n_{Y{{\rm{O}}_2}}}}} = 1,5 < 2 \Rightarrow \) phản ứng tạo ra 2 muối
\(\left\{ \begin{array}{l}
HY{\rm{O}}_3^ – :\,x\,mol\\
Y{\rm{O}}_3^{2 – }:y\,mol
\end{array} \right.\)
Ta có sơ đồ chuyển hóa :
\(\begin{array}{l}
Y{{\rm{O}}_2} + O{H^ – } \to HY{\rm{O}}_3^ – + Y{\rm{O}}_3^ – \,\,\,\,\,(1)\\
Y{\rm{O}}_3^{2 – } + B{a^{2 + }} \to BaY{{\rm{O}}_3}\downarrow
\end{array}\,\,\,\,\,(2) \)
Dựa vào mol \(YO_2\) và \(OH^-\) :
Bài 6.45: Hấp thụ hết 3,35 lít khí \(SO_2\) (đktc) vào dung dịch NaOH thu được dung dịch X chứa 2 muối. Thêm \(Br_2\) dư vào dung dịch X, phản ứng xong thu được dung dịch Y. Cho dung dịch Y tác dụng với lượng dư dung dịch \(Ba(OH)_2\), thu được kết tủa. Tính khối lượng kết tủa thu được sau khi phản ứng xảy ra hoàn toàn.
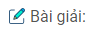
Ta thấy khi cho \(Br_2\) dư vào dung dịch 2 muối \(S^{4+} (Na_2SO_3\, và,\ NaHSO_4\)) thì toàn bộ \(S^{4+}\) sẽ bị oxi hoá lên \(S^{6+} (SO_4^{2-}\)), do đó :
\(nSO_2 = n _{SO_4^{2-}}- =0,15\) => \(m_{BaSO_4}\) = 0,15.233 = 34,95 (gam).
Bài 6.46: Hấp thu hoàn toàn 3,36 lít (đktc) hỗn hợp khí \(CO_2\) và \(SO_2\) vào 500 ml dung dịch NaOH có nồng độ a mol/l, thu được dung dịch X có khả năng hấp thụ tối đa 2,24 lít \(CO_2\). (đktc). Xác định a.
Kí hiệu \(CO_2\) và \(SO_2\) là \(YO_2\) => \(\sum {{n_{Y{{\rm{O}}_2}}}} _{ (đã\,dùng)}= 0,25 mo1\)
Chất tan sinh ra khi dung dịch NaOH hấp thụ tối đa \(YO_2\) sẽ là \(NaHYO_3\).
\(\left. \begin{array}{l}
Y{{\rm{O}}_2} + NaOH \to NaHY{{\rm{O}}_3}\\
0,25\,\,\,\,\,\,\,\,0,25
\end{array} \right\} \Rightarrow a = \frac{{0,25}}{{0,5}} = 0,5\left( {mol/l} \right)\)

