Bài 6.5: Nêu phương pháp hoá học để phân biệt các chất khí không màu sau : hiđro clorua, cacbon đioxit, oxi, ozon.
 Có thể phân biệt các khí này bằng trình tự những thí nghiệm :
Có thể phân biệt các khí này bằng trình tự những thí nghiệm :
Dùng dung dịch \(Ca(OH)_2\) để nhận ra khí cacbonic.
Dùng dung dịch chứa hỗn hợp KI và hồ tinh bột để nhận ra khí ozon.
Dùng giấy quỳ tím tẩm nước để nhận ra khí hiđro clorua.
Khí còn lại là oxi được nhận ra bằng than hồng.
Bài 6.6: So sánh thể tích khí oxi thu được (đktc) khi nhiệt phân hoàn toàn \(KMnO_4, KClO_3\) trong các trường hợp sau :
a) Các chất có cùng khối lượng.
b) Các chất có cùng số mol.
PTHH của phản ứng điều chế khí oxi :
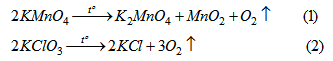
Nếu các chất có cùng khối lượng :
Theo (1) : 316 g \(KMnO_4\) điều chế được 1 mol \(O_2\).
Theo (2) : 245 g \(KClO_3\) điểu chế được 3 mol \(O_2\).
Vậy 316 g \(KClO_3\) điều chế được : \({{3.316} \over {245}} \approx 3,87\left( {mol} \right){O_2}\).
Kết luận : Nếu dùng cùng một khối lượng thì thể tích khí oxi thu được từ \(KClO_3\) nhiều hơn 3,87 lần so với \(KMnO_4\).
b) Nếu các chất có cùng số mol :
Advertisements (Quảng cáo)
Theo (1): 2 mol \(KMnO_4\) điều chế được 1 mol khí \(O_2\).
Theo (2) : 2 mol \(KClO_3\) điều chế được 3 moi khí \(O_2\).
Kết luận : Nếu dùng cùng số mol thì thể tích khí oxi thu được từ \(KClO_3\) nhiều hơn 3 lần so với \(KMnO_4\).
Bài 6.7: Điền vào bảng sau để so sánh hai thí nghiệm về điện phân các dung dịch :
|
Điều chế |
Dung dịch điện phân |
Sản phẩm ở cực dương (anot) |
Sản phẩm ở cực âm (catot) |
|
Khí oxi |
|
|
|
|
Khí clo |
|
|
|
Viết các phương trình điện phân.
Ta có bảng sau khi điền
|
Điều chế |
Dung dịch điện phân |
Sản phẩm ở cực dương |
Sản phẩm ở cực âm |
|
Khí oxi |
H2O pha thêm H2SO4 |
Khí oxi |
Khí hiđro |
|
Khí clo |
NaCl (có màng ngăn) |
Khí clo |
Khí hiđro |
Phương trình điện phân :
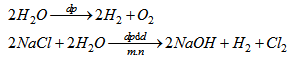
6.1. Điền vào bảng sau để so sánh hai thí nghiệm về điện phân các dung dịch :
|
Điều chế |
Dung dịch điện phân |
Sản phẩm ở cực dương (anot) |
Sản phẩm ở cực âm (catot) |
|
Khí oxi |
|
|
|
|
Khí clo |
|
|
|
Viết các phương trình điện phân.
Advertisements (Quảng cáo)
Ta có bảng sau khi điền :
|
Điều chế |
Dung dịch điện phân |
Sản phẩm ở cực dương |
Sản phẩm ở cực âm |
|
Khí oxi |
H2O pha thêm H2SO4 |
Khí oxi |
Khí hiđro |
|
Khí clo |
NaCl (có màng ngăn) |
Khí clo |
Khí hiđro |
Bài 6.8: Điều chế khí oxi bằng cách nhiệt phân \(KMnO_4\). Kết quả của thí nghiệm được ghi lại như sau :
|
Thời gian (s) |
Thể tích O2 thu được (cm3) |
Thời gian (s) |
Thể tích O2 thu được (cm3) |
|
0 |
0 |
40 |
78 |
|
10 |
8 |
50 |
87 |
|
20 |
28 |
60 |
90 |
|
30 |
57 |
70 |
90 |
a) Vẽ đồ thị biểu diễn thể tích khí oxi thu được theo thời gian (trục tung là thể tích khí oxi, trục hoành là thời gian).
b) Dùng đồ thị để cho biết thể tích khí oxi thu được ở thời điểm :
– 25 giây
– 45 giây
c) Ở thời điểm nào thì phản ứng kết thúc ?
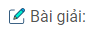
a) Xem đồ thị sau :
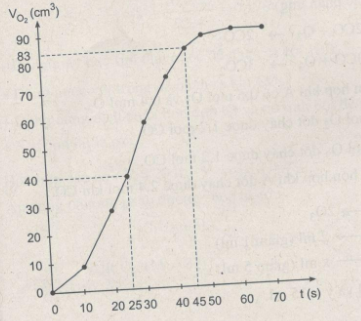
b) Thể tích khí oxi thu được ở các thời điểm :
25 giây : Khoảng 40 \(cm^3\).
45 giây : Khoảng 83 \(cm^3\).
c) Phản ứng kết thúc ở thời điểm 60 giây và thể tích khí oxi thu được là 90 \(cm^3\)
|
Thời gian (s) |
Thể tích O2 thu được (cm3) |
Thời gian (s) |
Thể tích O2 thu được (cm3) |
|
0 |
0 |
40 |
78 |
|
10 |
8 |
50 |
87 |
|
20 |
28 |
60 |
90 |
|
30 |
57 |
70 |
90 |
Bài 6.9
a) Cho biết tên hai dạng thù hình của nguyên tố oxi.
b) So sánh tính chất hoá học của hai dạng thù hình. Dẫn ra PTHH để minh hoạ.
a) hai dạng thù hình của nguyên tố oxi là oxi \(O_2\) và ozon \(O_3\)
b) So sánh tính chất hoá học của oxi và ozon
|
oxi |
ozon |
|
Là một phi kim hoạt động (do có độ âm điện lớn 3,44 chỉ kém F). a. Tác dụng với kim loại Tác dụng với hầu hết kim loại (trừ Ag, Au và Pt) → oxit. Các phản ứng thường xảy ra ở nhiệt độ cao. 2Mg + \(O_2\) → 2MgO 3Fe + 2\(O_2\) → \(Fe_3O_4\) (thường tạo hỗn hợp 4 chất rắn) b. Tác dụng với phi kim – Oxi phản ứng với hầu hết các phi kim (trừ halogen) tạo thành oxit axit hoặc oxit không tạo muối. – Các phản ứng thường xảy ra ở nhiệt độ cao. S + \(O_2 → SO_2\) C + \(O_2 → CO_2\) 2C + \(O_2\) → 2CO N2 + O2 → 2NO (\(3000^oC\), có tia lửa điện) c. Tác dụng với hợp chất có tính khử 2CO + \(O_2 → 2CO_2\) \(4FeS_2 + 11O_2 → 2Fe_2O_3 + 8SO_2\)
|
– Có tính oxi hóa mạnh hơn Oxi: \(O_3 + 2KI + H_2O → 2KOH + I_2 + O_2\) \(2Ag + O_3 → Ag_2O + O_2\) (phản ứng xảy ra ngay ở nhiệt độ thường).
|
Bài 6.10: Có một hỗn hợp khí gồm oxi và ozon. Hỗn hợp khí này có ti khối đối với hiđro bằng 18. Hãy xác định thành phần phần trăm theo thể tích của hỗn hợp khí.
Khối lượng mol trung bình của hỗn hợp khí:
\(\overline M = {\rm{ }}18.2 = 36\left( {g/mol} \right)\)
Đặt x và y là số mol \(O_3\) và \(O_2\)có trong 1 mol hỗn hợp khí, ta có phương trình đại số :
\({{48{\rm{x}} + 32y} \over {x + y}} = 36\)
Giải phương trình, ta có y = 3x. Biết rằng tỉ lệ phần trăm về số mol khí cũng là tỉ lệ về thể tích : Thể tích khí oxi gấp 3 lần thể tích khí ozon. Thành phần của hỗn hợp khí là 25% ozon và 75% oxi.

