Bài 19 Luyện tập tính chất của cacbon, silic và hợp chất của chúng SBT Hóa lớp 11. Giải bài 3.24, 3.25, 3.26 trang 25. Câu 3.24: Hãy dẫn ra ba phản ứng trong đó co thể hiện tính khử và ba phản ứng trong đó CO2 thể hiện tính oxi hoá…; Khi đun nóng dung dịch, khí CO2 thoát ra khỏi dung dịch do độ tan của CO2 giảm khi tăng nhiệt độ …
Bài 3.24: Hãy dẫn ra ba phản ứng trong đó co thể hiện tính khử và ba phản ứng trong đó CO2 thể hiện tính oxi hoá.
Ba phản ứng trong đó CO2 thể hiện tính khử :
\(2CO + {O_2}\)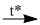 \(2C{O_2}\)
\(2C{O_2}\)
+2 +4
\(3CO + F{{\rm{e}}_2}{O_3}\)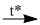 \(2F{\rm{e}} + 3C{O_2}\)
\(2F{\rm{e}} + 3C{O_2}\)
+2 +4
\(CO + C{l_2}\)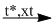 \(COC{l_2}\)
\(COC{l_2}\)
+2 +4
Ba phản ứng trong đó CO2 thể hiện tính oxi hoá :
\(C{O_2} + C\)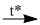 \(2CO\)
\(2CO\)
+4 +2
Advertisements (Quảng cáo)
\(C{O_2} + 2Mg\)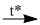 \(2MgO + C\)
\(2MgO + C\)
+4 0
\(C{O_2} + Zn\)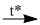 \(ZnO + CO\)
\(ZnO + CO\)
+4 +2
Bài 3.25: Cân bằng sau đây được thiết lập khi hoà tan khí CO2 trong nước CO2 + H2O\(\mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) H2CO3. Cân bằng đó chuyển dịch như thế nào khi đun nóng dung dịch, khi thêm NaOH và khi thêm HCl ? Giải thích.
Theo đầu bài, có cân bằng :
Advertisements (Quảng cáo)
CO2 + H2O\(\mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) H2CO3
– Khi đun nóng dung dịch, khí CO2 thoát ra khỏi dung dịch do độ tan của CO2 giảm khi tăng nhiệt độ. Vì vậy, cân bằng trên chuyển dịch từ phải sang trái.
– Khi thêm NaOH cân bằng trên chuyển dịch từ trái sang phải vì nồng độ H2CO3 giảm do phản ứng :
H2CO3 + 2NaOH \( \to \) Na2CO3 + 2H2O
– H2CO3 là axit yếu, trong dung dịch nó phân li ra ion H+. Do đó, khi thêm HCl, tức thêm ion H+, cân bằng trên sẽ chuyển dịch từ phải sang trái.
Bài 3.26: Cho 14,3 g Na2CO3.10H2O vào 200 g dung dịch CaCl2 3%. Sau phản ứng, cho từ từ 1,5 lít (đktc) khí CO2 vào hỗn hợp thu được, rồi lọc lấy kết tủa. Tính khối lượng kết tủa, biết rằng chỉ có 60% lượng CO2 tham gia phản ứng.
\({n_{CaC{l_2}}} = \frac{{200.3}}{{100.111}} = {5,4.10^{ – 2}}(mol)\)
\({n_{N{a_2}C{O_3}}} = {n_{N{a_2}C{O_3}.10{H_2}O}} = \frac{{14,3}}{{286}} = {5.10^{ – 2}}(mol)\)
CaCl2 + Na2CO3 \( \to \) CaCO3\( \downarrow \) + 2NaCl (1)
5.10-2 mol 5.10-2 mol 5.10-2 mol
Hỗn hợp thu được gồm có CaCO3, NaCl và CaCl2 dư.
Khi cho CO2 \(({n_{C{O_2}}} = \frac{{1,5}}{{22,4}} = {6,7.10^{ – 2}}mol)\) vào hỗn hợp, xảy ra phản ứng :
CO2 + CaCO3 + H2O \( \to \) Ca(HCO3)2 (2)
Theo (2), số mol CaCO3 bị hoà tan = số mol CO2 phản ứng
= 6,7.10-2.\(\frac{{60}}{{100}}\) = 4,02.10-2 (mol).
Khối lượng kết tủa CaCO3 thu được là :
(5.10-2 – 4,02.10-2).100 = 0,98 (g).

