Bài 2: Trình bày phương pháp hóa học:
a) Phân biệt các khí đưng trong các bình riêng biệt không dán nhãn: H2, O2, CH4, C2H4, C2H2.
b) tách riêng khí CH4 từ hỗn hợp với lượng nhỏ các khí C2H4 và C2H2.
a) Phân biệt các bình đựng khí riêng biệt: H2, O2, CH4, C2H4, C2H2.
– Dẫn từng khí qua dung dịch AgNO3 tring NH3, khí cho kết tủa vàng nhạt là C2H2.
CH = CH + 2AgNO3 + 2NH3 → AgC ≡ CAg ↓ + 2NH4NO3
– Dẫn lần lượt 4 khí còn lại qua dung dịch brom, khí nào làm mất màu dung dịch bron là khí C2H4.
CH2 = CH2 + Br2 → CH2Br – CH2Br
– Ba khí còn lại, nhận ra khí O2 bằng tàn đóm còn than hồng: khí O2 làm tàn đóm bùng cháy.
– Hai khí còn lại, cho lần lượt từng khí phản ứng với khí oxi, khí nào cho sản phẩm làm đục nước vôi trong là khí CH4.
Advertisements (Quảng cáo)
CH4 + 2O2 → CO2 + 2H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
Bài 3: Viết phương trình hóa học của các phản ứng hoàn thành dãy chuyển hóa sau:
a) Etan \(\overset{(1)}{\rightarrow}\) etilen \(\overset{(2)}{\rightarrow}\) politilen.
b) Metan \(\overset{(1)}{\rightarrow}\) axetilen \(\overset{(2)}{\rightarrow}\) vinylaxetilen \(\overset{(3)}{\rightarrow}\) butanđien \(\overset{(4)}{\rightarrow}\) polibutađien.
c) Benzen → brombenzen.
Advertisements (Quảng cáo)
a) (1) C2H6 \(\overset{t^{o},xt}{\rightarrow}\) C2H4 + H2
(2) nCH2 = CH2 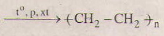 b) (1) 2CH4 \(\overset{1500^{o}C}{\rightarrow}\) C2H2 + 3H2
b) (1) 2CH4 \(\overset{1500^{o}C}{\rightarrow}\) C2H2 + 3H2
(2) 2CH ≡ CH \(\overset{t^{o},xt}{\rightarrow}\) CH2 = CH – C ≡ CH
(3) CH2 = CH – C ≡ CH + H2 \(\xrightarrow[t^{o}]{Pd/PbCO_{3}}\) CH2 = CH – CH = CH2
(4) nCH2 = CH – CH – CH2 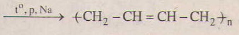 c)
c) 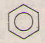 + Br \(\xrightarrow[t^{o}]{Fe}\)
+ Br \(\xrightarrow[t^{o}]{Fe}\) 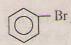 + HBr.
+ HBr.
Bài 4: Viết phương trình hóa học tổng quát của phản ứng đốt cháy các loại hiđrocacbon đã nêu trong bảng 7.2. Nhận xét về tỉ lệ giữa số mol CO2 và số mol H2O trong sản phẩm của mỗi loại hiđrocacbon.
CnH2n+2 +\(\frac{3n+1}{2}\)O2 \(\overset{t^{o}}{\rightarrow}\) nCO2 + (n+1)H2O có \(\frac{n_{CO_{2}}}{n_{H_{2}O}}\) < 1.
CnH2n + \(\frac{3n}{2}\)O2 \(\overset{t^{o}}{\rightarrow}\) nCO2 + nH2O có \(\frac{n_{CO_{2}}}{n_{H_{2}O}}\) = 1.
CnH2n-2 + \(\frac{3n-1}{2}\)O2 \(\overset{t^{o}}{\rightarrow}\) nCO2 + (n-1)H2O có \(\frac{n_{CO_{2}}}{n_{H_{2}O}}\) > 1.
CnH2n-6 + \(\frac{3n-3}{2}\)O2 \(\overset{t^{o}}{\rightarrow}\) nCO2 + (n-3)H2O có \(\frac{n_{CO_{2}}}{n_{H_{2}O}}\) > 1.
Bài 5: Khi đốt cháy hoàn toàn hiđrocacbon X (là chất lỏng ở điều kiện thường) thu được CO2 và H2O có số mol theo tỉ lệ 2 : 1. Công thức phân tử của X có thể là công thức nào sau đây?
A. C4H4. B. C5H12. C. C6H6. D. C2H2.
Chọn C.

