Bài 2: Axit, bazo và muối SBT Hóa lớp 11. Giải bài 1.11, 1.12, 1.13, 1.14 trang 4, 5. Câu 1.11: Viết phương trình điện li của các chất sau trong dung dịch…; Các muối thường gọi là “không tan”, ví dụ BaS04, AgCl có phải là các chất điện li mạnh không ?
Bài 1.11: Viết phương trình điện li của các chất sau trong dung dịch :
1. Axit mạnh H2Se04 (nấc thứ nhất điện li mạnh).
2. Axit yếu ba nấc H3P04.
3. Hiđroxit lưỡng tính Pb(OH)2.
4. Na2HP04.
5. NaH2P04.
6. Axit mạnh HMn04.
7. Bazơ mạnh RbOH.
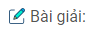
1. H2Se04 \( \to \) H+ + HSe\({O_4}^ – \)
HSe\({O_4}^ – \) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) H+ + Se\({O_4}^{2 – }\)
2. H3P04 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) H+ + H2P\({O_4}^ – \)
H2P\({O_4}^ – \) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) H+ + HP\({O_4}^{2 – }\)
HP\({O_4}^{2 – }\) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) H+ + P\({O_4}^{3 – }\)
Advertisements (Quảng cáo)
3. Pb(OH)2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) Pb2+ + 2\(O{H^ – }\)
\({H_2}Pb{O_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{H^ + } + Pb{O_2}^{2 – }\)
4. Na2HP04 \( \to \) 2Na+ + HP\({O_4}^{2 – }\)
HP\({O_4}^{2 – }\) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) H+ + P\({O_4}^{3 – }\)
5. NaH2P04 \( \to \) Na+ + H2P\({O_4}^ – \)
H2P\({O_4}^ – \) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) H+ + P\({O_4}^{3 – }\)
HP\({O_4}^{2 – }\) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) H+ + P\({O_4}^{3 – }\)
6. HMn04 \( \to \) H+ + Mn\({O_4}^ – \)
Advertisements (Quảng cáo)
7. RbOH \( \to \) Rb+ + \(O{H^ – }\)
Bài 1.12: Các muối thường gọi là “không tan”, ví dụ BaS04, AgCl có phải là các chất điện li mạnh không ? Giải thích, biết rằng ở 25°C độ hoà tan trong nước của BaS04 là 1,0.10-5 mol/l, của AgCl là 1,2.10-5 mol/l. Dung dịch các muối này chỉ chứa các ion, không chứa các phân tử hoà tan.
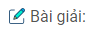
BaS04 và AgCl là các chất điện li mạnh, vì các phân tử hoà tan của chúng đều phân li ra ion.
Bài tập 1.13: Hai chất điện li mạnh A và B khi tan trong nước phân li ra a mol Mg2+, b mol Na+, c mol SO4– và d mol Cl :
1. Biết a = 0,001 ; b = 0,01 ; c = 0,005 ; vậy d bằng bao nhiêu ?
2. Viết công thức phân tử của A và B.
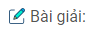
1. Trong dung dịch, điện tích của các cation bằng điện tích của các anion, nên :
2a + b = 2c + d
0,001.2 + 0,01 = 0,005.2 + d
\( \Rightarrow \) d = 0,002
2. MgCl2 và Na2S04.
Bài 1.14: Trong một dung dịch \(C{H_3}\)COOH, người ta xác định được nồng độ H+ bằng 3.10-3M và nồng độ \(C{H_3}\)COOH bằng 3,97.10-1M. Tính nồng độ mol ban đầu của \(C{H_3}\)COOH.
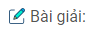
Gọi C là nồng độ moi ban đầu của \(C{H_3}\)COOH, ta có :
\(C{H_3}COOH \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} C{H_3}CO{O^ – } + {H^ + }\)
(C – 3.10-3)M 3.10-3M 3.10-3M
C – 3.10-3 = 3,97.10-1 = 397.10-3
C = 397.10-3 + 3.10-3 = 400.10-3
\( \Rightarrow \) C = 0,4M.

