Câu 5. Hãy viết phương trình hóa học của các phản ứng sau và gọi tên sản phẩm tạo thành:
a) \(C{H_3}CHBrC{H_2}C{H_3}\) với dung dịch \(NaOH/{H_2}O\), đun nóng.
b) \(C{H_3}CHBrC{H_2}C{H_3}\) với dung dịch KOH/ancol, đun nóng.
Giải
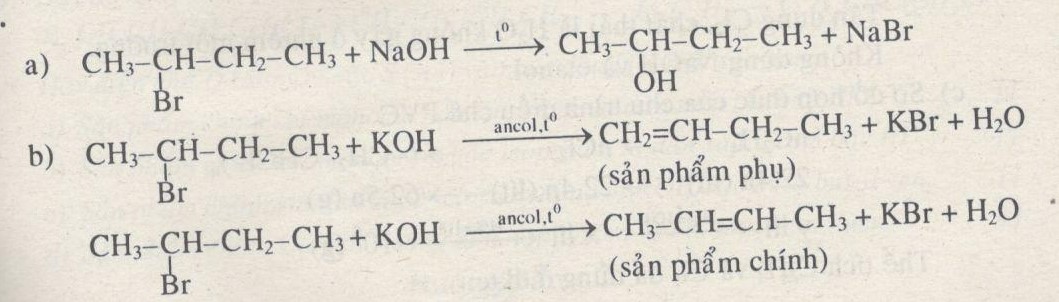
Câu 6. Hãy hoàn thành các sơ đồ phản ứng tổng hợp PVC và poli cloroprn cho dưới đây và cho biết hiện nay PVC được tổng hợp theo sơ đồ phản ứng nào ?
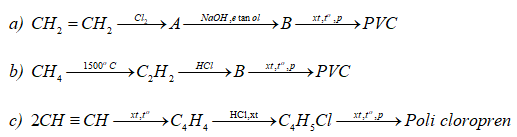
Giải

Câu 7. Hãy phân biệt các chất sau bằng phương pháp hóa học:
a) Hexyl bromua, brombenzen, 1-brombut-2-en.
b) 1-Clopent-2-en, pent-2-en, 1-clopentan.
Advertisements (Quảng cáo)
Giải
a) – Dùng dung dịch \(B{r_2}\), mất màu dung dịch \(B{r_2}\) là \(C{H_2}Br – CH = CH – C{H_3}\)
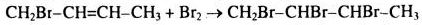
– Đun hai mẫu còn lại với dung dịch NaOH, chiết lấy phần nằm dưới (ancol nổi lên trên) cho tác dụng với dung dịch \(AgN{O_3}\) thấy có kết tủa vàng nhạt là hexyl bromua. Mẫu còn lại là benzen.
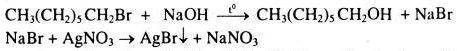
b) Tương tự câu a, dùng dung dịch \(B{r_2}\): Hai mẫu làm mất màu dung dịch \(B{r_2}\) là 1-clopent-2-en và pent-2-en. Mẫu còn lại là 1-clopentan. Thủy phân 1-clopent-2-en và pent-2-en, rồi dùng dung dịch \(AgN{O_3}\)
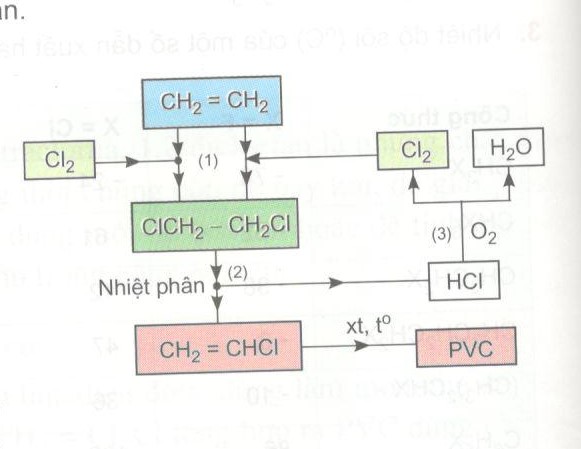
Câu 8. Trong công nghiệp ngày nay người ta điều chế poli (vinyl clorua) (PVC) theo sơ đồ:
Advertisements (Quảng cáo)
a) Từ sơ đồ kĩ thuật đã cho, hãy viết phương trình hóa học của phản ứng xảy ra ở giai đoạn clo hóa (1), giai đoạn nhiệt phân (2) và giai đoạn chuyển HCl thành \(C{l_2}\) (3)
b) Nêu ưu điểm của sơ đồ này so với sơ đồ điều chế PVC cho ở cấu (a) và (b) bài tập 6
c) Tính thể tích etilen và khí clo (đktc) cần để sản xuất 1 tấn PVC theo sơ đồ trên, giả sử các phản ứng đều đạt hiệu suất 100%.
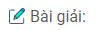
a)
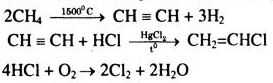
b) Ưu điểm:
– Tận dụng \(C{l_2}\) , chất thải là \({H_2}O\) không gây ô nhiễm môi trường.
– Không dùng NaOH và etanol
c) Sơ đồ hợp thức của chu trình điều chế PVC
\(n{C_2}{H_4} \to nC{l_2} \to {\left( { – C{H_2}CHCl – } \right)_n}\)
\(22,4n(l) \to 22,4n(l) \to 62,5n(g)\)
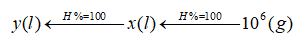
Thể tích \({C_2}{H_4}\) và \(C{l_2}\) đã dùng ở đktc:
\({V_{{C_2}{H_4}}} = {V_{C{l_2}}} = {{{{10}^6}.22,4n} \over {62,5n}} = 358400\) (lít)

