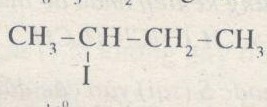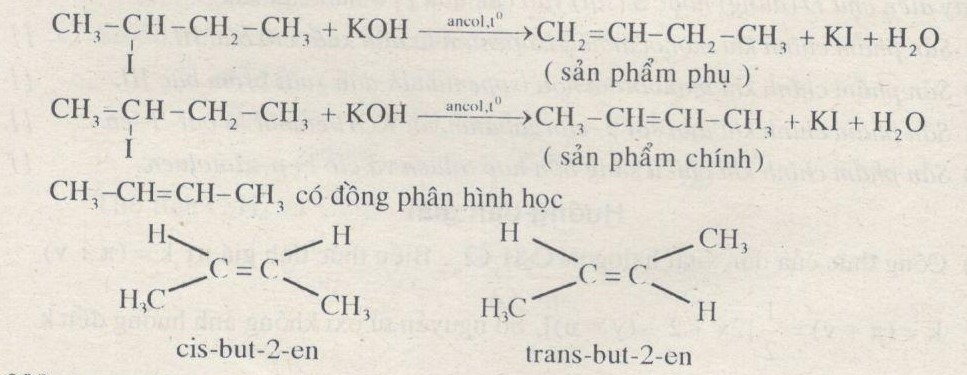Câu 1. a) Hãy thiết lập biểu thức tính giá trị đối với dẫn xuất halogen (xem bài \(\left( {\pi + v} \right)\) tập 1 ở bài 44)
b) Tính \(\left( {\pi + v} \right)\) đối với các chất sau: \({C_6}{H_6}C{l_6},{C_5}{H_5}Cl,{C_8}{H_5}B{r_3},{C_{12}}{H_4}C{l_4}{O_2}\)
a) Công thức củau dẫn xuất halogen \({C_x}{H_y}C{l_u}.\) Biểu thức tính giá trị \(k = \left( {\pi + v} \right)\)
\(k = \left( {\pi + v} \right) = {1 \over 2}\left[ {2x + 2 – \left( {y + u} \right)} \right]\). Số nguyên tử oxi không ảnh hưởng đến k.
b) Áp dụng công thức tren ta tính được giá trị k của \({C_6}{H_6}C{l_6},{C_5}{H_5}Cl,{C_8}{H_5}B{r_3},{C_{12}}{H_4}C{l_4}{O_2}\) lần lượt là 1, 3, 5 và 9
Câu 2. a) Trong hai liên kết C-Cl và H-Cl liên kết nào phân cực hơn, vì sao ? b) Vì sao dẫn xuất halogen hầu như không tan trong nước mà tan tốt trong dung môi hữ cơ như hiđrocacbon, ete, ancol ?
Giải
a) Liên kết C-Cl. Hiệu độ âm điện là \(\Delta \lambda = 3,16 – 2,55 = 0,61\)
Liên kết H-Cl. Hiệu độ âm điện là \(\Delta \lambda = 3,16 – 2,2 = 0,96\)
Advertisements (Quảng cáo)
\( \Rightarrow \Delta {\lambda _{HCl}} > \Delta {\lambda _{CCl}} \Rightarrow \) Liên kết H-Cl phân cực hơn liên kết C-Cl
b) Các dẫn xuất halogen đều là hợp chất cộng hóa trị nên thực tế không tan trong \({H_2}O\), chúng tan trong dung môi hữu cơ.
Câu 3. Cho các hợp chất sau: 2-clobutan, vinyl bromua, benzyl clorua. Dùng công thức cấu tạo hãy viết phương trình nếu xảy ra phản ứng vủa từng hợp chất lần lượt với các tác nhân sau:
a) \(NaOH/{H_2}O/{t^o}\)
b) \(KOH/butan ol/{t^o}\)
c) \(Mg/{\rm{ete}}\)
Advertisements (Quảng cáo)
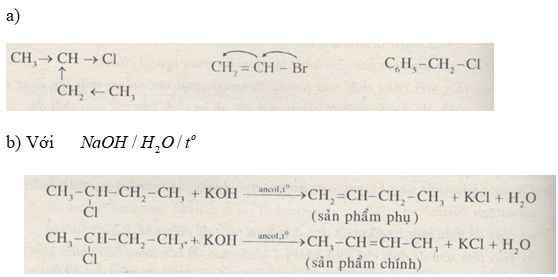
\(C{H_2} = CH – Br\) do hiệu ứng cộng hưởng \(p – \pi \) nên thường không tác dụng với NaOH ở nhiệt độ thường và đun nóng.
Với \(KOH/butan ol/{t^o}\)
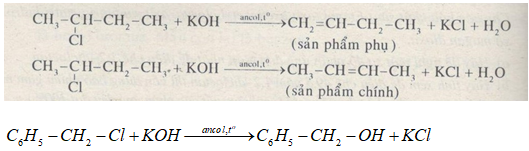
Với \(Mg/{\rm{ete}}\)
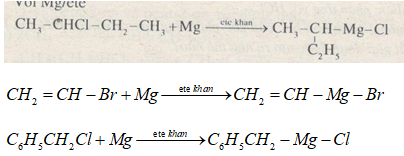
Câu 4. Khi đun sôi dung dịch gồm \({C_4}{H_9}I\), etanol và KOH người ta thu được 3 anken mà khi hiđro hóa chúng thì đều nhận được butan. Hãy viết sơ đồ phản ứng tạo ra các anken và cho biết anken nào là sản phẩm phụ.
Giải
Công thức cấu tạo của \({C_4}{H_9}I\) là