Câu 4. Khi nung một hỗn hợp gồm cát trắng và than cốc trong lò điện \({3500^o}C\) thì thu được một hợp chất chứa khoảng 70% Si và khoảng 30% C. Viết phương trình hóa học của phản ứng đó, biết rằng một trong các sản phẩm của phản ứng là cacbon monoxit.
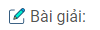
\(S{i_x}{C_y}.\)Ta có: \(x:y = \frac{{\% Si}}{{28}}:\frac{{\% C}}{{12}} = \frac{{70}}{{28}}:\frac{{30}}{{12}} = 2,5:2,5 = 1:1.\)Công thức của hợp chất tạo thành sau phản ứng là .
Phương trình phản ứng:
Câu 5. Cho khí \(CO_2\) tan vào nước cất có pha vài giọt quỳ tím. Màu của dung dịch chuyển thành:
A. Xanh B. Tím
C. Đỏ D. Không màu
Sau khi đun nong dung dịchmột thời gian thì màu chuyển thành
Advertisements (Quảng cáo)
A. Xanh B. Tím
C. Đỏ D. Không màu
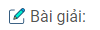
Chọn C: Vì
Advertisements (Quảng cáo)
Chọn B. Đun nóng \(CO_2\) bay đi, môi trường trở lại trung tính.
Câu 6. Viết các phương trình hóa học của phản ứng biểu diễn sơ đồ chuyển hóa sau:
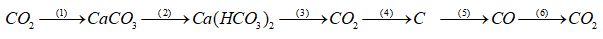
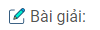
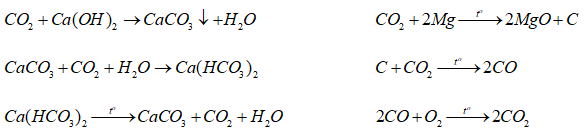
Câu 7. Xác định thể tích hiđro (đktc) thoát ra khí cho lượng dư dung dịch natri hiđroxit tác dụng với một hỗn hợp thu được bằng cách nấu chảy 6 gam magie với 4,5 silic đioxit. Giả sử phản ứng được tiến hành với hiệu suất 100%.
Giải
\({n_{Mg}} = \frac{6}{{24}} = 0,25mol;{n_{Si{O_2}}} = \frac{{4,5}}{{60}} = 0,075mol\)

\(Si + 2NaOH + {H_2}O \to N{a_2}Si{O_3} + 2{H_2} \uparrow \)
0,075 \( \to \) 0,15
Thể tích \({H_2}\) thoát ra ở đktc: \({V_{{H_2}}} = 0,15.22,4 = 3,36\) (lít)

