Bài 1: Khái niệm sự chuẩn độ ? Khái niệm điểm tương đương ? Khái niệm điểm cuối .Cho thí dụ minh họa.
+ Sự chuẩn độ là sự tiến hành phản ứng xác định nồng độ của dung dịch.
+ Điểm tương đương là thời điểm chất cần xác định nồng độ vừa tác dụng hết với dung dịch chuẩn.
+ Điểm cuối là thời điểm kết thúc chuẩn độ.
Ví dụ

Bài 2: Cần phải thêm bao nhiêu ml dung dịch NaOH 0,25M vào 50ml dung dịch hỗn hợp HCl 0,1M và H2SO4 0,05M để thu được dung dịch có pH = 2,0 ?
A. 43, 75ml B. 36, 54ml
Advertisements (Quảng cáo)
C. 27, 75 ml D. 40, 75mL
Chọn B
Giả sử H2SO4 điện li hoàn toàn .
Đặt thể tích tích dung dịch NaOH cần tìm là V (lít)
Advertisements (Quảng cáo)
Ta có: \(pH = 2 \Rightarrow {\left[ {{H^ + }} \right]_\text{dư}} = {10^{ – 2}}M \Rightarrow {n_{{H^ + }\text{dư}}} = {10^{ – 2}}\left( {V + 0,05} \right)mol.\)
\(\eqalign{
& HCl\,\,\,\,\,\,\, \to {H^ + } + C{l^ – } \cr
& 0,005\mathrel{\mathop{\kern0pt\longrightarrow}
\limits_{}} 0,005 \cr
& {H_2}S{O_4} \to 2{H^ + } + SO_4^{2 – } \cr
& 0,0025\buildrel {} \over
\longrightarrow 0,005 \cr
& \Rightarrow {n_{{H^ + }}} = 0,005 + 0,005 = 0,01\,mol \cr
& NaOH \to N{a^ + } + O{H^ – } \cr
& 0,25V\buildrel {} \over
\longrightarrow 0,25V \cr} \)
\({H^ + } \;\;\;+ \;\;\;\;\;\;\;O{H^ – } \;\;\to {H_2}O\)
Trước phản ứng \(0,01\) \(0,25V\)
Phản ứng \(\,\,0,25V\;\;\;\buildrel {} \over
\leftarrow \;\;\;\;0,25V\)
Sau Phản ứng \((0,01- 0,25V)\) \( 0\)
\(\Rightarrow {n_{{H^ + }\text{dư}}} = 0,01 – 0,025V = {10^{ – 2}}\left( {V + 0,05} \right)mol\)
\(\Rightarrow V =0,03654l= 36,54\,ml.\)
Bài 3: Từ các số liệu sau hãy vẽ biểu đồ biểu thị sự biến thiên pH của dung dịch trong quá trình chuẩn độ dung dịch HCl 0,100M bằng dung dịch NaOH 0,100M. Trục hoành ghi thể tích dung dịch NaOH , trục tung ghi pH của dung dịch . Đường biểu diễn trên đồ thị đó gọi là đường định phân.
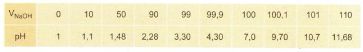
 :
:
Đồ thị: