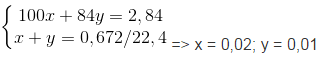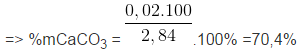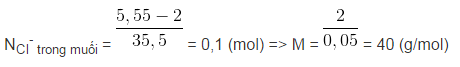[Bài 26 Hóa học 12] giải bài 1 trang 118; bài 2, 3, 4, 5, 6, 7, 8, 9 trang 119 SGK Hóa lớp 12: Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ
1. Kim loại kiềm thổ
– Thuộc nhóm IIA, đứng sau nguyên tố kim loại kiềm trong mỗi chu kì.
– Tính chất vật lí: tương đối mềm, nhiệt độ nóng chảy thấp.
– Có 2e lớp ngoài cùng (ns2).
– Tính chất hóa học: có tính khử mạnh (tác dụng với phi kim, dung dịch axit, nước):
M → M2+ + 2e
2. Một số hợp chất của Ca
– Ca(OH)2: là một baz ơ mạnh, dung dịch Ca(OH)2 có tính chất chung của một baz ơ tan; được dùng trong xây dựng, trồng trọt và sản xuất clorua vôi.
– CaCO3: bị nhiệt phân hủy; bị hòa tan bởi CO2 trong nước ở nhiệt độ thương; được dùng nhiều trong ngành công nghiệp, xây dựng, thực phẩm, …
– CaSO4: tùy theo lượng nước kết tinh trong muối, có ba loại.
+ CaSO4.2H2O (thạch cao sống): bền ở nhiệt độ thường; được dùng để sản xuất xi măng.
+ CaSO4.2H2O hoặc CaSO4.5H2O (thạch cao nung); được dùng để đúc tượng, trang trí nội thất,…
+ CaSO4 (thạch cao khan): không tan và không tác dụng với nước.
3. Nước cứng
– Là nước có chứa nhiều ion Ca2+ và Mg2+.
– Nước cứng được chia làm 3 loại.
+ Tính cứng tạm thời: do các muối Ca(HCO3)2, Mg(HCO3)2 gây ra.
+ Tính cứng vĩnh cửu: do các muối CaCl2, MgCl2, CaSO4, MgSO4 gây ra.
+ Tính cứng toàn phần: gồm cả tính cứng tạm thời và tính cứng vĩnh cửu.
– Tác hại của nước cứng: gây nhiều trở ngại cho đời sống hang ngày, cho nhiều ngành sản xuất.
– Phương pháp làm mềm nước cứng: loại bỏ các ion Ca2+ , Mg2+ bằng CO32-, PO43-,…
Giải bài tập bài 26 Hóa 12 trang 118,119: Kim loại kiềm thổ
Bài 1: Xác định kim loại kiềm thổ theo chiều tăng dần của điện tích hạt nhân, thì
A. Bán kính nguyên tử giảm dần.
B. Năng lượng ion hóa giảm dần.
C. tính khử giảm dần.
D. Khả năng tác dụng với nước giảm dần.
Đáp án đúng: B
Bài 2 : Cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 sẽ
A. Có kết tử trắng.
Advertisements (Quảng cáo)
B. Có bọt khí thoát ra.
C. Có kết tử trắng và bọt khí.
D. Không có hiện tượng gì.
Đáp án đúng: A
Bài 3 (Hóa 12 trang 119): Cho 2,84 gam hỗn hợp CaCO3 và MgCO3 tác dụng hết với dung dịch HCl thấy bay ra 672 ml khí CO2 (đktc). Phần trăm khối lượng của 2 muối (CaCO3, MgCO3) trong hỗn hợp là
A. 35,2% và 64,8%. B. 70,4% và 29,6%.
C. 85,49% và 14,51%. D. 17,6% và 82,4%.
Chọn B.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
x x (mol)
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
y y (mol)
Ta có phương trình:
%mMgCO3 = 100% – 70,4% = 29,6%
Bài 4 : Cho 2 gam một kim loại thuộc nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55 gam muối clorua. Kim loại đó là kim loại nào sau đây?
A. Be; B. Mg; C. Ca; D. Ba.
Chọn C.
M + 2HCl → MCl2 + H2
Advertisements (Quảng cáo)
Kim loại là Ca.
Bài 5 trang 119: Cho 2,8 gam CaO tác dụng với một lượng nước lấy dư thu được dung dịch A. Sục 1,68 lít CO2 (đktc) vào dung dịch A.
a)Tính khối lượng kết tủa thu được.
b)Khi đun nóng dung dịch A thì khối lượng kết tủa thu được tối đa là bao nhiêu?

a) nCaO = – 0,05 (mol); nCO2 = = 0,075 (mol)
CaO + H2O → Ca(OH)2
0,05 0,05 (mol)
A < nCO2 : nCa(OH)2 < 2 => tạo thành muối
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
0,05 0,05 0,05 (mol)
CaCO3 + CO2 + H2O → Ca(HCO3)2
0,025 (0,75 – 0,05) 0,025 (mol)
mCaCO3↓ = 100.(0,05-0,025) = 100.0,025 = 2,5 (gam)
b) Khi đun nóng dung dịch:
Ca(HCO3)2 –t°–> CaCO3 + CO2 + H2O
0,025 0,025 (mol)
Khối lượng kết tủa tối đa thu được là: 0,05.100 = 5 (gam).
Bài 6 trang 119: Khi lấy 14,25 gam muối clorua của một kim loại chỉ có hóa trị II và một khối lượng muối nitrat của kim loại đó có số mol bằng số mol muối clorua thì thấy khác nhau 7,95 gam. Xác định tên kim loại.
Đáp án bài 6:
Gọi số mol của muối MCl2 là x, ta có:
(M + 124).x – (M + 71).x = 7,95 => x = 0,15
MMCl2= 14,25/0,15 = 95 (g/mol) => MM = 95 – 71 = 24 (g/mol)
Kim loại M là Mg.
Vậy hai muối là MgCl2 và Mg(NO3)2.
Bài 7 trang 119: Hòa tan 8,2 gam hỗn hợp bột CaCO3 và MgCO3 trong nước cần 2,016 lít CO2 (đktc).
Xác định khối lượng mỗi muối trong hỗn hợp.
H/d giải bài 7:
Gọi số mol của CaCO3 và MgCO3 trong hỗn hợp là x, y.
CaCO3 + CO2 + H2O → Ca(HCO3)2
x x (mol)
MgCO3 + CO2 + H2O → Mg(HCO3)2
y y (mol)
Ta có hệ phương trình: => x = 0,04; y 0,05
=>m CaCO3 = 0,04.100 = 4 (gam)
mMgCO3 = 84.0,05 = 4,2 (gam).
Bài 8: Trong một cốc nước có chứa 0,01 mol Na+, 0,02 mol Ca2+, 0,01 mol Mg2+, 0,05 mol HCO3–, 0,02 mol Cl–. Nước trong cốc thuộc loại nào?
A. Nước cứng có tính cứng tạm thời. B. Nước cứng có tính cứng vĩnh cửu.
C. Nước cứng có tính cứng toàn phần. D. Nước mềm.
Đáp án đúng: C
Bài 9: Viết phương trình hóa học của phản ứng để giải thích việc dùng Na3PO4 làm mềm nước cứng có tính cứng toàn phần.
H/d :
Các PTHH:
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2 ↓ + 6NaHCO3
3Mg(HCO3)2 + 2Na3PO4 → Mg3(PO4)2 ↓ + 6NaHCO3
3CaCl2 + 2Na3PO4 → Ca3(PO4)2 ↓ + 6NaCl
3CaSO4 +2Na3PO4 → Ca3(PO4)2 ↓ + 3Na2SO4.