Câu 7. Cho nước brom vào hỗn hợp phenol và axit axetic, đến khi ngừng mất màu nước brom thì lọc và thu được 33,1 g kết tủa trắng. Để trung hòa phần nước lọc, cần dùng hết 248 ml dung dịch NaOH ( \(D = 1,11g/{m^3}\)). Xác định thành phần phần trăm hỗn hợp ban đầu.
Giải
Số mol \(NaOH:{{248.1,11} \over {40.100}}.10 = 0,69\) mol; số mol kết tủa: \({{33,1} \over {331}} = 0,1\) mol
\({C_6}{H_5}OH + 3B{r_2} \to {C_6}{H_2}OHB{r_3} \downarrow + 3HBr\) (1)
0,1 \( \leftarrow \) 0,1 \( \to \) 0,3
Phần nước lọc gồm HBr 0,3 mol: \(C{H_3}{\rm{COO}}H\)
\(HBr + NaOH \to NaBr + {H_2}O\) (2)
0,3 \( \to \) 0,3
\(C{H_3}{\rm{COO}}H + NaOH \to C{H_3}{\rm{COO}}Na + {H_2}O\) (3)
0,39 \( \leftarrow \) 0,39 = (0,69 – 0,3)
Từ (2) \( \Rightarrow {n_{NaOH}} = 0,3mol \)
\(\Rightarrow {n_{NaOH(3)}} = 0,39mol \Rightarrow {n_{C{H_3}{\rm{COO}}H}} = 0,39mol\)
\(\eqalign{
& \% {m_{C{H_3}COOH}} = {{0,39.60} \over {0,39.60 + 0,1.94}} = 71,34\% \cr
& \% {m_{{C_5}{H_5}OH}} = 100\% – 71,34\% = 28,66\% \cr} \)
Câu 8*. Kết quả phân tích nguyên tố cho thấy hợp chất A chứa 55,81% C, 7,01% H còn lại là oxi; A là chất lỏng ít tan trong nước, không có vị chua, không làm mất màu nước brom. 1,72 ga A phản ứng vừa đủ với 20,0 ml dung dịch NaOH 1,0M và tạo thành một hợp chất duy nhất B có công thức phân tử \({C_4}{H_7}{O_3}Na\). Khi đun nóng với dung dịch axit vô cơ, từ B lại tạo thành A.
a) Xác định công thức phân tử của A
b) Từ công thức phân tử và tính chất của A, cho biết A thuộc loại hợp chất nào.
Advertisements (Quảng cáo)
c) Viết công thức cấu tạo của A, B và các phương trình đã nêu.
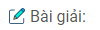
%O = 100 – (55,81 + 7,01) = 37,18%; số mol NaOH 0,02 mol
Đặt công thức tổng quát của A: \({C_x}{H_y}{O_z}\)
Ta có \(x:y:z = {{\% C} \over {12}}:{{\% H} \over 1}:{{\% O} \over {16}} = 2:3:1\)
Công thức đơn giản của A : \({({C_2}{H_3}O)_n}\)
A không có vị chua \( \Rightarrow \) A không phải là axit. A tác dụng được với dung dịch kiềm tạo ra sản phẩm B: \({C_4}{H_7}{O_3}Na\) và A không làm mất màu dung dịch brom \( \Rightarrow \) A là este đơn chức mạch vòng \( \Rightarrow \) \({n_A} = nNaOH = 0,02mol \Rightarrow {M_A} = 86\) đvC
Công thức phân tử của A: \({C_4}{H_6}{O_2}\)
Công thức cấu tạo của A:
Advertisements (Quảng cáo)
Câu 9*. Tổng hợp isoamyl axetta (để làm “dầu chuối”) gồm 3 giai đoạn như sau:
A: Cho 60,0 ml axit axetic “băng” (axit 100%, \(D = 1,05g/c{m^3}\)), 108,6 ml 3-metylbuatn-1-ol (ancol isoamylic, \(D = 0,81g/c{m^3}\), nhiệt độ dôi xem bảng 8.3) và 1 ml \({H_2}S{O_4}\) vào bình cầu có nắp máy khuấy, ống sinh hàn (xem hình vẽ ở đầu chương) rồi đun sôi trong vòng 8 giờ)
B: Sau khi để nguội, lắc hỗn hợp thu được với nước, chiết bỏ lớp nước rồi lắc với dung dịch \(N{a_2}C{O_3}\), chiết bỏ lớp dung dịch nước, lại lắc hỗn hợp thu được với nước, chiết bỏ lớp nước.
C: Chưng cất lấy sản phẩm ở \(142 – {143^o}C\) thu được 60,0 ml isomyl axettat. Isomyl axetat là chất lỏng \(D = 0,87g/c{m^3}\), sôi ở \(142,{5^o}C\) , có mùi thơm như mùi chuối chín (mùi dầu chuối).
a) Dùng hình vẽ đề mô tả 3 giai đoạn A, B, C (xem hình 4.1, 4.2)
b)Viết phương trình hóa học của phản ứng xảy ra ở giai đoạn A và B.
c) Tính hiệu suất của phản ứng.
a) Cho axit axetic, ancol isomylic, axit sunfuric vào bình cầu đun trên bếp cách cát trong 4 giờ
Để nguội, rửa sản phẩm bằng nước, chiết loại bỏ \({H_2}S{O_4}\) và \(C{H_3}{\rm{COO}}H\) dư. Tiếp tục lắc hỗn hợp với \(N{a_2}C{O_3}\), chiết và chưng cất sản phẩm ở \(142 – {143^o}C\) thu được isoamyl axetat.
b) 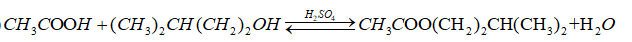
\(2C{H_3}{\rm{COO}}H + N{a_2}C{O_3} \to 2C{H_3}{\rm{COONa + C}}{{\rm{O}}_2} \)
\(+ {H_2}O\)
\({H_2}S{O_4} + N{a_2}C{O_3} \to N{a_2}S{O_4} + C{O_2} \uparrow + {H_2}O\)
c) Khối lượng axit ban đầu: m = 60.1,05 = 63 (g) \( \Rightarrow {n_{{\rm{ax}}it}} = 1,05\) mol
Khối lượng ancol isoamylic ban đầu: m = 108,6.0,81 = 88 (g) \( \Rightarrow {n_{ancol}} = 1\) mol
Khối lượng este thu được: m = 66.0,87 = 52 (g) \( \Rightarrow {n_{{\rm{es}}te}} = 0,4\) mol
Ancol là chất thiếu, dựa vào ancol để tính hiệu suất
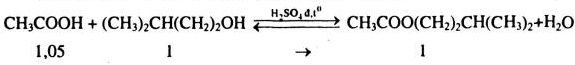
Hiệu xuất \(H\% = {{{n_{pu}}} \over {{n_{bd}}}}.100 = {{0,4.100} \over 1} = 40\% \)

