Câu 7. Khi đốt cháy hoàn toàn một hiđrocacbon ở thể khí (điều kiện thường) thì thấy thể tích các khí tạo thành sau phản ứng đúng bằng thể tích khi tham gia phản ứng (ở cùng nhiệt độ và áp suất). Hãy cho biết hiđrocacbon đó có thể nhận những công thức phân tử như thế nào ?
Hiđrocacbon khí ở điều kiện thường nên \(1 \le x \le 4\) và \(0 \le y \le 2x + 2\)
Xét 1 mol \({C_x}{H_y}:\)
\({C_x}{H_y} + \left( {x + \frac{y}{4}} \right){O_2} \to xC{O_2} + \frac{y}{2}{H_2}O\)
1 \( \to \) \(\left( {x + \frac{y}{4}} \right)\) \( \to \) x \( \to \) \(\frac{y}{2}\)
Theo đề bài ta có: \(1 + x + \frac{y}{4} = x + \frac{y}{2} \Rightarrow y = 4\)
Công thức phân tử của hiđrocacbon có thể là \(C{H_4},{C_2}{H_4},{C_3}{H_4},{C_4}{H_4}\)
Câu 8*. Hỗn hợp khí A gồm 2 chất kế tiếp nhau trong dãy đồng đẳng của etilen. Cho 3,36 lít (đktc) hỗn hợp khí trên phan ứng hoàn toàn với \(B{r_2}\) trong \(CC{l_4}\) thì thấy khối lượng bình chứa brom tăng thêm 7,7 gam
a) Hãy xác định công thức phân tử của hai loại anken đó.
b) Xác định thành phần phần trăm về thể tích hỗn hợp A.
c) Viết công thức cấu tạo của anken đồng phân có cùng công thức phân tử với hai anken đã cho
a) Đặt công thức tổng quart của anken thứ nhất là \({C_n}{H_{2n}}\) (x mol), công thức tổng quát của anken thứ 2 là \({C_m}{H_{2m}}\) (y mol)
Công thức chung của hai anken là \({C_{\overline n}}{H_{2{\overline n}}}\) (a mol)
\({C_{\overline n}}{H_{2{\overline n}}} + B{r_2} \to {C_{\overline n}}{H_{2{\overline n}}}B{r_2}\)
Advertisements (Quảng cáo)
Số mol hỗn hợp A là \(\frac{{3,36}}{{22,4}} = 0,15\) mol
Theo đề bài ta có: \(0,15.14\mathop n\limits^ – = 7,7 \)
\(\Rightarrow n = 3 < {\overline n} = 3,67 = \frac{{11}}{3} < m = 4\)
Công thức phân tử của hai anken là \({C_3}{H_6}\) và \({C_4}{H_8}\)
b) Ta có: \(\left\{ \begin{array}{l}x + y = a\\\frac{{nx + my}}{{x + y}} = \mathop n\limits^ – \end{array} \right. \Rightarrow \left\{ \begin{array}{l}x + y = 0,15\\\frac{{3x + 4y}}{{x + y}} = \frac{{11}}{3}\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}x = 0,05\\y = 0,1\end{array} \right.\)
Thành phần phần trăm thể tích mỗi anken:
\(\% {V_{{C_3}{H_6}}} = \frac{{0,05.100\% }}{{0,15}} = 33,33\% ;\)
\(\% {V_{{C_4}{H_8}}} = 100\% – 33,33 = 66,67\% \)
c) Công thức cấu tạo của \({C_3}{H_6}\): \(C{H_3} – CH = C{H_2}\) Propen
Công thức cấu tạo của \({C_4}{H_8}\):
\(C{H_3} – C{H_2} – CH = C{H_2}\) But-1-en
Advertisements (Quảng cáo)
\(C{H_3} – CH = CH – C{H_3}\) But-2-en
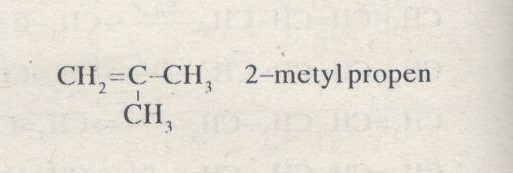
But-2-en có đồng phân hình học:

Câu 9*. Nhiệt phân 2,8 lít (đktc) etan ở \({1200^o}C\) rồi cho một nửa hỗn hợp khí thu được sục qua bình đựng brom (dư) thì thấy khối lượng bình này tăng thêm 1,465 g. Cho nửa hỗn hợp khí còn lại phản ứng với dung dich \(AgN{O_3}\) trong amoniac thì thu được 0,60 g kết tủa màu vàng. Biết rằng phản ứng nhiệt phân tạo ra etilen, axetilen là phản ứng không hoàn toàn, các phản ứng tiếp sau đó đều xảy ra hoàn toàn. Hãy xác định thành phần phần trăm về thể tích của hỗn hợp thu được.
Số mol \({C_2}{H_6}\) ban đầu \(\frac{{2,8}}{{22,4}} = 0,125\) mol. Đặt số mol \({C_2}{H_6}\) tham gia phản ứng (1), (2) lần lượt là 2x mol và 2y mol
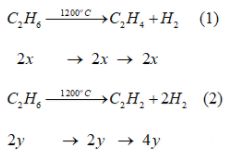
Hỗn hợp sau phản ứng: \({C_2}{H_4}\) 2x mol, \({C_2}{H_2}\) 2y mol, \({H_2} \left( {2x + 4y} \right)\) mol.
\({C_2}{H_6}\)dư [0,125 – (2x+2y)] mol.
\({C_2}{H_4} + B{r_2} \to {C_2}{H_4}B{r_2};\)
\({C_2}{H_2} + 2B{r_2} \to {C_2}{H_2}B{r_4}\)
Ta có \({m_{{C_2}{H_4}}} + {m_{{C_2}{H_2}}} = m\) bình tăng \( \Rightarrow 28x + 26y = 1,465(*)\)
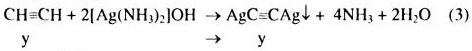
Từ (3) \( \Rightarrow y = \frac{{0,6}}{{240}}(**)\)
Giải hệ (*) và (**) ta được \(\left\{ \begin{array}{l}x = 0,05\\y = 0,0025\end{array} \right.\)
Hỗn hợp sau phản ứng:
\({C_2}{H_4}\) 0,1 mol, \({C_2}{H_2}\) 0,005 mol, \({H_2}\) 0,11 mol, \({C_2}{H_6}\) dư 0,02 mol.
Số mol hỗn hợp sau phản ứng: 0,1 + 0,005 + 0,11 + 0,02 = 0,235 mol
Thành phần phần trăm thể tích các khí trong hỗn hợp sau phản ứng:
\(\% {V_{{C_2}{H_4}}} = \frac{{0,1.100\% }}{{0,235}} = 42,55\% \) \(\% {V_{{C_2}{H_2}}} = \frac{{0,005.100\% }}{{0,235}} = 2,13\% \)
\(\% {V_{{H_2}}} = \frac{{(0,1 + 0,005.2).100\% }}{{0,235}} = 46,80\% \) \(\% {V_{{C_2}{H_6}}} = \frac{{0,02.100\% }}{{0,235}} = 8,51\% \)

