Câu 1. Viết công thức cấu tạo của:
a)Canxi cacbua
b) Nhôm cácbua
c) Cacbon tetraflorua
Trong các hợp chất trên số oxi hóa của cacbon là bao nhiêu ?
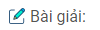
Câu 2. a) Tại sao cacbon monooxit cháy được, còn cacbon đioxit không cháy được trong khí quyển oxi ?
b) Hãy phân biệt khí \(CO\) và khí \({H_2}\) bằng phương pháp hóa học. Viết phương trình hóa học của phản ứng để minh họa.
Giải
a) \(CO\) cháy được trong \({O_2}\) vì \(CO\) có tính khử và \({O_2}\) có tính oxi hóa. \(C{O_2}\) không có tính khử nên không cháy được trong \({O_2}\).
Advertisements (Quảng cáo)
\(2\mathop C\limits^{ + 2} O + {O_2} \to 2\mathop C\limits^{ + 4} {O_2}\)
b) Cách 1: Đốt hai khí rồi dẫn sản phẩm cháy qua bình đựng nước vôi trong dư. Mẫu tạo kết tủa là \(C{O_2}\) \( \Rightarrow CO\). Mẫu còn lại là \({H_2}\)
\(CO + {O_2} \to C{O_2}\)
\(C{O_2} + Ca{(OH)_2} \to CaC{O_3} \downarrow + {H_2}O\)
Cách 2: Cho hai mẫu thử tác dụng với \(PdC{l_2}\), mẫu tạo kết tủa đen là \(CO\), mẫu còn lại là \({H_2}\).
\(PdC{l_2} + CO + {H_2}O \to Pd \downarrow \)đen \( + C{O_2} \uparrow + 2HCl\)
Advertisements (Quảng cáo)
Câu 3. a) Làm thế nào để phân biệt khí \(C{O_2}\) và khí \({O_2}\):
– Bằng phương pháp vật lí
– Bằng phương pháp hóa học
b) Làm thế nào để phân biệt muối natri cacbonat và muối natri sunfit ?
a) Bằng phương pháp vật lí: Nén ở áp suất cao \(C{O_2}\) dễ hóa lỏng hơn \({O_2}\).
Phương pháp hóa học: Dùng dung dịch nước vôi trong dư nhận biết được \(C{O_2}\) vì tạo ra kết tủa trắng. Mẫu còn lại là \({O_2}\).
\(C{O_2} + Ca{(OH)_2} \to CaC{O_3} \downarrow + {H_2}O\)
b) Hòa tan hai muối vào dung dịch HCl dư, dẫn khí tạo thành vào dung dịch nước brom. Khí làm mất màu dung dịch nước brom là \(S{O_2} \Rightarrow N{a_2}S{O_3}\) . Mẫu còn lại là \(N{a_2}C{O_3}\).
\(N{a_2}C{O_3} + 2HCl \to 2NaCl + C{O_2} \uparrow + {H_2}O\)
\(N{a_2}S{O_3} + 2HCl \to 2NaCl + S{O_2} \uparrow + {H_2}O\)
\(S{O_2} + B{r_2} + 2{H_2}O \to 2HBr + {H_2}S{O_4}\)

