Câu 1. Phát biểu các định nghĩa axit và bazơ theo thuyết A-rê-ni-ut và thuyết Bron – stêt. Lấy các thí dụ minh họa.
* Theo thuyết A-rê-ni-út:
– Axit là chất khi tan trong nước phân li ra cation H+.
Thí dụ : \(HCl \rightarrow H^+ + Cl^-\)
\(CH_3COOH \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} H^+ + CH_3COO^-\)
– Bazơ là chất khi tan trong nước phân li ra anion OH-.
Thí dụ : \(NaOH \rightarrow Na^+ + OH^-\)
* Theo thuyết Bron – stêt:
– Axit là chất nhường proton (H+) . Bazơ là chất nhận proton.
Axit \(\mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}}\) Bazơ + \(H^+\)
– Thí dụ 1:
\(CH_3COOH +H_2O\mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} H_3O^+ + CH_3COO^-\)
CH3COOH + H2O ↔ H3O+ + CH3COO-
– Thí dụ 2:
\(NH_3 + H_2O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}}NH_4^+ + OH^-\)
Câu 2. Thế nào là bazơ một nấc và nhiều nấc, axit một nấc và axit nhiều nấc. Hiđroxit lưỡng tính, muối trung hòa, muối axit. Lấy các thí dụ và viết phương trình điện li của chúng trong nước.
Advertisements (Quảng cáo)
a) Axit nhiều nấc
– Những axit khi tan trong nước mà phân tử phân li một nấc ra ion \(H^+\) là các axit một nấc.
– Những axit khi tan trong nước mà phân tử phân li nhiều nấc ra ion \(H^+\) là các axit nhiều nấc.
– Thí dụ:
\(HCl \to {H^ + } + C{l^ – }\)
Ta thấy phân tử HCl trong dung dịch nước chỉ phân li một nấc ra ion \(H^+\), đó là axit một nấc.
\(\eqalign{
& {H_3}P{O_4} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + {H_2}P{O_4}^ – \cr
& {H_2}P{O_4}^ – \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + HP{O_4}^{2 – } \cr
& HP{O_4}^{2 – } \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + P{O_4}^{3 – } \cr} \)
Phân tử \({H_3}P{O_4}\) phân li ba nấc ra ion \(H^+\); \({H_3}P{O_4}\) là axit ba nấc.
b) Bazơ nhiều nấc
– Những bazơ khi tan trong nước mà phân tử phân li một nấc ra ion \(OH^-\) là các bazơ một nấc.
– Những bazơ khi tan trong nước mà phân tử phân li nhiều nấc ra ion \(OH^-\) là các bazơ nhiều nấc.
– Thí dụ:
Advertisements (Quảng cáo)
\(NaOH \to N{a^ + } + O{H^ – }\)
Phân tử NaOH khi tan trogn nước chỉ phân li một nấc ra ion \(OH^-\), NaOH là bazơ một nấc.
\(\eqalign{
& Mg{(OH)_2} \to Mg{(OH)^ + } + O{H^ – } \cr
& Mg{(OH)^ + } \to M{g^{2 + }} + O{H^ – } \cr} \)
Phân tử \(Mg{(OH)_2}\) phân li hai nấc ra ion \(OH^-\), \(Mg{(OH)_2}\) là bazơ hai nấc.
c) Hidroxit lưỡng tính
Hidroxit lưỡng tính là hidroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ.
– Thí dụ: \(Zn{(OH)_2}\) là hidroxit lưỡng tính:
\(Zn{(OH)_2} \to Z{n^{2 + }} + 2O{H^ – }\): Phân li theo kiểu bazơ
\(Zn{(OH)_2} \to 2{H^ + } + Zn{O_2}^{2 – }\) (*) : Phân li theo kiểu axit
d) Muối trung hòa
Muối mà anion gốc axit không còn hidro có khả năng phân li ra ion H+ (hidro có tính axit) được gọi là muối trung hòa.
– Thí dụ: \(NaCl, (NH4)_2 SO_4, Na_2CO_3\).
\({\left( {N{H_4}} \right)_2}S{O_4} \to 2N{H_4}^ + + S{O_4}^{2 – }\)
e) Muối axit
Nếu anion gốc axit của muối vẫn còn hidro có khả năng phân li ra ion \(H^+\), thì muối đó được gọi là muối axit.
– Thí dụ: \(NaHCO_3, NaH_2PO_4 , NaHSO_4\).
\(NaHCO_3\to Na^+ + HCO_3^-\)
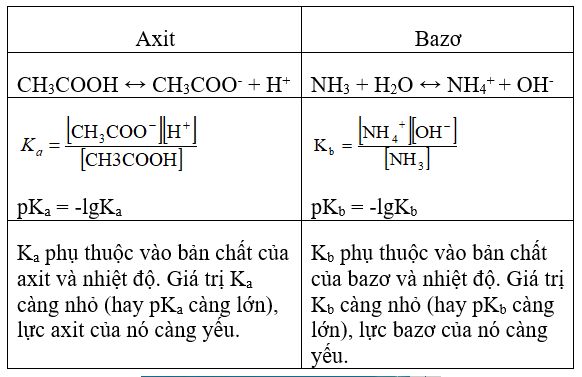
Câu 3. Hằng số phân li axit, hằng số phân li bazơ là gì ? Lấy thí dụ.
Câu 4. Kết luận nào dưới đây là đúng theo thuyết A-rê-ni-ut ?
A. Một hợp chất trong thành phần phân tử hiđro là axit.
B. Một hợp chất trong thành phần phân tử có nhóm OH và bazơ
C. Một hợp chất trong thành phần phân tử có hiđro và phân li ra \({H^ + }\) trong nước là axit.
D. Một bazơ không nhất thiết phải có nhóm OH trong thành phần phân tử.
Chọn đáp án C

