[Bài 28 Hóa học 12] giải bài 1,2,3,4,5,6 trang 132 : Luyện tập tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
Một số hợp chất quan trọng của kim loại kiềm.
– NaOH: là bazơ mạnh, tan nhiều trong nước và tỏa nhiệt.
– NaHCO3: tác dụng được với axit và kiềm.
– Na2CO3: là muối của axit yếu, có đầy đủ tính chất chung của muối.
Bài 1: Cho 3,04 gam hỗn hợp NaOH và KOH tác dụng với dung dịch axit HCl thu được 4,15 gam hỗn hợp muối clorua. khối lượng của mỗi muối hiđrôxit trong hỗn hợp lần lượt là
A. 1,17 gam và 2,98 gam. B. 1,12 gam và 1,6 gam.
C. 1,12 gam và 1,92 gam. D. 0,8 gam và 2,24 gam.
Bài 2. Sục 6,72 lít khí CO2 (đktc) vào dung dịch có chứa 0,25 mol Ca(OH)2. Khối lượng kết tủa thu được là
A.10 gam. B. 15 gam.
C. 20 gam. D. 25 gam.
HD: nCO2 = 6,72/22,4 = 0,3 (mol)
Ta thấy: 1 < nCO2 : nCa(OH)2 = 0,3:0,25 < 2
Vậy xảy ra 2 phản ứng:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
x x x (mol)
Advertisements (Quảng cáo)
2CO2 + Ca(OH)2 → Ca(HCO3)
y y y (mol)
Ta có hệ phương trình:
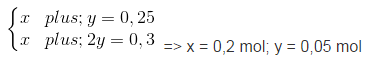
mCaCO3 = 0,2.100 = 20 (gam).
Bài 3: Chất nào sau đây có thể dùng để làm mềm nước cứng có tính cứng vĩnh cửu?
A. NaCl; B. H2SO4;
C. Na2CO3; D. HCl.
Bài 4 trang 132: Có 28,1 gam hỗn hợp MgCO3 và BaCO3 trong đó MgCO3 chiếm a% khối lượng. Cho hỗn hợp trên tác dụng hết dụng với dung dịch axit HCl để lấy khí CO2 rồi đem sục vào dung dịch có chứa 0,2 mol Ca(OH)2 được kết tủa b. Tính a để kết B thu được là lớn nhất.
Hướng dẫn giải bài 4:
Advertisements (Quảng cáo)
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
m x
BaCO3 + 2HCl → BaCl2 + CO2 + H2O
y y
CO2 + Ca(OH)2 → CaCO3↓ + H2O.
(x+y) (x + y)

Từ (1), (2)
![]()
Bài 5: Cách nào sau đây thường được dùng để điều chế kim loại Ca?
A. Điện phân dung dịch CaCl2 có màng ngăn.
B. Điện phân CaCl2 nóng chảy;
C. Dùng Al để khử CaO ở nhiệt độ cao;
D. Dùng kim loại Ba để đẩy Ca ra khỏi dung dịch CaCl2.
Bài 6 trang 132 Hóa: Sục a mol khí CO2 vào dung dịch Ca(OH)2 thu được 3 gam kết tủa. Lọc tách kết tủa, dung dịch còn lại mang đun nóng thu thêm được 2 gam kết tủa nữa. Giá trị của a là
A. 0,05 mol. B. 0,06 mol.
C. 0,07 mol. D. 0,08 mol.
Giải: nCaCO3 (1) = 0,03 mol; nCaCO3 (3) = 0,02 mol.
CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
0,03 0,03 (mol)
2CO2 + Ca(OH)2 → Ca(HCO3) (2)
0,04 0,04 (mol)
Ca(HCO3)3 —-> CaCO3 + CO2 + H2O (3)
0,02 0,02 (mol)
Từ (1), (2) và (3) => nCO2 = a = 0,03 + 0,04 = 0,07 (mol).

