Hiểu cấu hình electron bất thường của nguyên tử crom, đồng và các oxit hóa thường gặp. Vận dụng giải bài tập trong sách giáo khoa trang 166,167 (Bài 1,2,3,4,5,6) – Hóa học lớp 12.
Bài 1. Hoàn thành phương trình hóa học của các phản ứng trong dãy chuyển đổi sau:
Cu → CuS → Cu(NO3)2 → Cu(OH)2 → CuCl2 → Cu.
Giải:
Cu + S → CuS
3CuS + 14HNO3 → 3Cu(NO3)2 +3H2SO4 + 8NO + 4H2O
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
CuCl2 → Cu +Cl2.
Bài 2. Khi cho 100 gam hợp kim gồm có Fe, Cr và Al tác dụng với lượng dư dung dich NaOH thu được 6,72 lít khí. Lấy phần rắn không tan cho tác dụng với lượng dư dung dịch HCl (khi không có không khí) thu được 38,08 lít khí. Các thể tích khí đo ở đktc. Xác định các thành phần % khối lượng của hợp kim.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,2
⇒ mAl = 27.0,2 = 5,4 (gam) ⇒ %mAl = 5,4 %.
Gọi số mol của Fe và Cr trong hỗn hợp là x và y.
Fe + 2HCl → FeCl2 + H2
x x(mol)
Cr + 2HCl → CrCl2 + H2
y y
Advertisements (Quảng cáo)
Ta có các phương trình : x + y = = 1,7 (1)
56x + 52y = 94,6 (2).
Giải hệ hai phương trình (1) và (2) ta được x = 1,55 ; y = 0,15.
⇒ mFe = 56.1,55 = 86,8 gam ; %mFe = 86,8%.
Và mCr = 52.0,15 = 7,8 (gam) ; %mCr = 7,8 %.
Bài 3. Hỗn hợp X gồm Cu và Fe, trong đó Cu chiếm 43,24% khối lượng. Cho 14,8 gam X tác dụng hết với dung dịch HCl thấy có V lít khí (đktc) bay ra. Gia trị của V là
A. 1,12 lít.
B. 2,24 lít.
C. 4,48 lít.
D. 3,36 lít.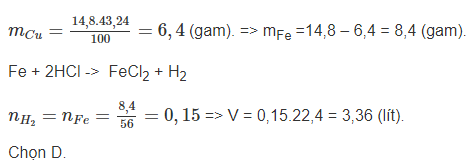
Advertisements (Quảng cáo)
Bài 4.
Khử m gam bột CuO bằng khí H2 ở nhiệt độ cao thu được hỗn hợp chất rắn X. Để hòa tan hết X cần vừa đủ 1 lít dung dịch HNO3 1M, thu được 4,48 lít khí NO duy nhất (đktc).
Hiệu suất của phản ứng khử CuO là :
A.70%.
B. 75%.
C. 80%.
D. 85%.
Hướng dẫn giải.
CuO + H2 → Cu + H2O (1)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (2)
CuO + 2HNO3 → Cu(NO3)2 + 2NO + 4H2 (3)
Ta có : nNO = 0,2 mol.
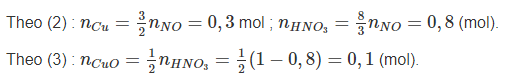
⇒ nCuO ban đầu = 0,1 + 0,3 = 0,4 (mol)
Hiệu suất của quá trình khử CuO là : ![]()
Bài 5. Nhúng thanh sắt vào dung dịch CuSO4, sau một thời gian lấy thanh sắt ra rửa sạch , sấy khô thì thấy khối lượng tăng 1,2 gam. Khối lượng Cu đã bám vào thanh sắt là :
A.9,3 gam.
B. 9,4 gam.
C. 9,5 gam.
D. 9,6 gam.
Bài 6. Cho Cu tác dụng với dung dịch hỗn hợp gồm NaNO3 và H2SO4 loãng để giải phóng khí nào sau đây?
A. NO2.
B. NO.
C. N2O.
D. NH3.
Hướng dẫn. 3Cu + 2NaNO3 + 4H2SO4 -> 3CuSO4 + Na2SO4 + 2NO + 4H2O

