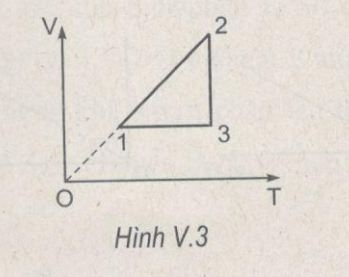
Bài ôn tập chương V chất khí SBT Lý lớ 10. Giải bài V.12. V.13, V.14 trang 75 Sách bài tập Vật lí 10. Câu V.12: Hình V.3 là đồ thị của sự biến đổi trạng thái của 1 mol khí lí tưởng trong hệ toạ độ (V, T)…
Bài V.12: Hình V.3 là đồ thị của sự biến đổi trạng thái của 1 mol khí lí tưởng trong hệ toạ độ (V, T). Hãy vẽ đồ thị của sự biến đổi trạng thái trên trong các hệ toạ độ (p, V) và (p, T).
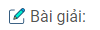
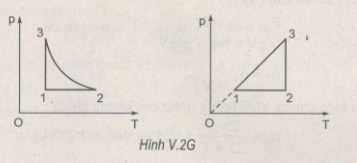
Xem hình V.2G
Quá trình (2-3) là đẳng nhiệt
Quá trình (3-1) là đẳng tích
Quá trình (1-2) là đẳng áp
Bài V.13*: Người ta nối hai pit-tông của hai xilanh giống nhau bằng một thanh cứng sao cho thể tích dưới hai pit-tông bằng nhau. Dưới hai pit-tông có hai lượng khí như nhau ở nhiệt độ T0, áp suất p0. Áp suất khí trong hai xilanh sẽ thay đổi như thế nào, nếu đun nóng một xilanh lên tới nhiệt độ T1 đổng thời làm lạnh xilanh kia xuống nhiệt độ T2? Khi đó, sự thay đổi thể tích tương đối của khí trong mỗi xilanh sẽ bằng bao nhiêu ? Bỏ qua trọng lượng của pit-tông và thanh nối ; coi ma sát không đáng kể ; áp suất của khí quyển là pa.
– Khí trong xi lanh bên trái
+ Trạng thái 1: Trước khi đun nóng: p0; V0; T0.
+ Trạng thái 2: Sau khi đun nóng: p1; V1; T1.
Vì khối lượng khí không đổi nên:
Advertisements (Quảng cáo)
\({{{p_0}{V_0}} \over {{T_0}}} = {{pV} \over T}\)(1)
– Khí trong xi lanh bên phải
+ Trạng thái 1( trước khi làm nguội): p0; V0; T0.
+ Trạng thái 2(sau khi làm nguội): p2; V1; T2.
Khối lượng khí không đổi nên:
\({{{p_0}{V_0}} \over {{T_0}}} = {{{p_2}{V_1}} \over {{T_2}}}\)(2)
Vì pit-tông cân bằng nên:
Ở trạng thái 1: 2pa = 2p0
Advertisements (Quảng cáo)
Ở trạng thái 2: 2p0 = p1 + p2 (3)
Sự thay đổi thể tích tương đối của khí trong xi lanh:
\(x = {{{V_0} – {V_1}} \over {{V_0}}}\) (4)
Từ (1), (2), (3), (4) suy ra :
\({p_1} = {{2{T_1}} \over {{T_1} + {T_2}}}{p_0};{p_2} = {{2{T_2}} \over {{T_1} + {T_2}}}{p_0};x = {{2{T_0} – {T_1} – {T_2}} \over {2{T_0}}}\)
Bài V.14*: Một khí cầu có thể tích V = 336 m3 và khối lượng vỏ m = 84 kg được bơm không khí nóng tới áp suất bằng áp suất không khí bên ngoài. Không khí nóng phải có nhiệt độ bằng bao nhiêu để khí cầu bắt đầu bay lên ? Biết không khí bên ngoài có nhiệt độ 27°C và áp suất 1 atm ; khối lượng mol của không khí ở điều kiện chuẩn là 29.10 3 kg/mol.
Gọi ρ1 và ρ2 là khối lượng riêng của không khí ở nhiệt độ T1 = 27 + 273 = 300 K và nhiệt độ T2 là nhiệt độ khi khí cầu bắt đầu bay lên.
Khi khí cầu bay lên:
FÁc-si-mét = Pvỏ khí cầu + Pcủa không khí nóng
ρ1gV = mg + ρ2gV
ρ2 = ρ1 – m/V (1)
Ở điều kiện chuẩn, khối lượng riêng của không khí là:
\({\rho _0} = {{29g} \over {22,4l}} = 1,295g/d{m^3} = 1,295kg/{m^3}\)
Vì thể tích của một lượng khí tỉ lệ thuận với nhiệt độ tuyệt đối khi áp suất không đổi nên khối lượng riêng của một lượng khí tỉ lệ nghịch với nhiệt độ tuyệt đối khi áp suất không đổi.
Ta có: \({\rho _1} = {{{T_0}} \over {{T_1}}}{\rho _0}\) (2)
Từ (1) và (2) suy ra: ρ1 = 1,178 kg/m3.
Do đó ρ2 = 0,928 kg/m3.
Vì \({\rho _2} = {{{T_0}} \over {{T_2}}}{\rho _0}\) nên \({T_2} = {{{T_0}{\rho _0}} \over {{\rho _2}}} = {{273.1,295} \over {0,928}} = 381K\)
t2 = 1080C.

